题目内容
【题目】过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:
CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。
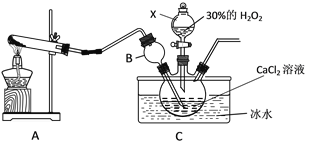
①装置A中发生反应的化学方程式为_______; 仪器X的名称为________。
②装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ.该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.________________________
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为__________________。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2mol·L—1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴__________溶液。
步骤三:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3溶液体枳为V mL。产品中CaO2·8H2O的质量分数为_________ (用字母表示)[已知:I2+2S2O32-=2I-+ S4O62-]
(3)钙在空气中燃烧生成氮化钙(Ca3N2),同时可能会生成CaO2。请限用下列试剂,设计实验检验钙在空气中燃烧所得固体中是否含有CaO2:______________(简要说明实验步骤、现象和结论)。限用试剂:稀盐酸、MnO2。
【答案】2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O分液漏斗(或滴液漏斗)温度高时H2O2会分解取最后一次洗涤后的滤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液(或硝酸酸化的硝酸银溶液),若无白色沉淀生成,则说明已经洗涤干净淀粉0.108Vc/a(或
CaCl2+2NH3↑+2H2O分液漏斗(或滴液漏斗)温度高时H2O2会分解取最后一次洗涤后的滤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液(或硝酸酸化的硝酸银溶液),若无白色沉淀生成,则说明已经洗涤干净淀粉0.108Vc/a(或 ![]() %或其他合理答案均可给分)取样品少许于试管中,加入稀盐酸使其完全溶解(1分),再加入MnO2粉末,如有气泡生成,则原固体中含有CaO2
%或其他合理答案均可给分)取样品少许于试管中,加入稀盐酸使其完全溶解(1分),再加入MnO2粉末,如有气泡生成,则原固体中含有CaO2
【解析】(1)①装置A是实验室利用氯化铵与氢氧化钙混合加热制氨气,发生反应的化学方程式为2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O; 装置中仪器X的名称为分液漏斗;
CaCl2+2NH3↑+2H2O; 装置中仪器X的名称为分液漏斗;
② 该反应是放热反应,温度低有利于提高CaO2·8H2O产率,同时H2O2不稳定,受热易分解,因此装置C采用冰水浴控制温度在0℃左右,可防止温度高时H2O2会分解;
③析出晶体表面溶液中含有Cl-,只要检验洗涤液中无Cl-,即可证明沉淀洗涤干净,具体操作为取最后一次洗涤后的滤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液(或硝酸酸化的硝酸银溶液),若无白色沉淀生成,则说明已经洗涤干净。
(2)步骤二:过氧化氢能氧化KI得到碘单质,因此滴定操作时可选择淀粉作指示剂;
步骤三:根据H2O2+2I-+2H+=2H2O+I2,I2+2S2O32-=2I-+ S4O62-可知:
CaO2~~H2O2~~~~~I2~~~~~~~2S2O32-,则CaO2的物质的量为![]() c mol·L—1×V×10-3L=0.5Vc×10-3mol;则产品中CaO2·8H2O的质量分数为
c mol·L—1×V×10-3L=0.5Vc×10-3mol;则产品中CaO2·8H2O的质量分数为![]() 100%=
100%=![]() %;
%;
(3)检验钙在空气中燃烧所得固体中是否含有CaO2,可取样品少许于试管中,加入稀盐酸使其完全溶解(1分),再加入MnO2粉末,如有气泡生成,则原固体中含有CaO2。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案