��Ŀ����
����Ŀ��A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʡ�����֮�������µķ�Ӧ��ϵ��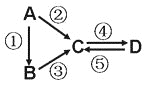
��1����D���ʾ������ԣ��ڢ۷�Ӧ��Ҫ��ǿ����Һ���ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���壬д���ڷ�Ӧ�����ӷ���ʽ_____________���ܷ�Ӧ�����ӷ���ʽ______________��
��2����A��Ӧ����㷺�Ľ������ܷ�Ӧ�õ�A���ڢݷ�Ӧ���õ�ͬһ�ֻ���ɫ���嵥�ʡ�д��A��ˮ��Ӧ�Ļ�ѧ����ʽ__________________���ܷ�Ӧ�����ӷ���ʽ___________________��
D�м����������Ƶ�������_____________________��
��3����A��̫���ܵ���õĹ�����ϡ�C��DΪ���Σ�����Һ���Լ��ԣ��ܷ�ӦҲ��ͨ��һ����������ЧӦ����Ҫ���塣д���ڷ�Ӧ�Ļ�ѧ����ʽ______________________________________��
�ݷ�Ӧ�õ�B����Ӧ����Ϊ���£���ݵĻ�ѧ����ʽΪ________________________________��
���𰸡� 2Al��2OH����2H2O == 2 AlO![]() ��3H2�� AlO
��3H2�� AlO![]() ��CO2(����)��2H2O == Al(OH)3����HCO
��CO2(����)��2H2O == Al(OH)3����HCO![]() 3Fe��4H2O(g)
3Fe��4H2O(g)![]() Fe3O4��4H2 Fe +2Fe3+ = 3Fe2+ ���ɵİ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ�� Si��2NaOH��H2O ==Na2SiO3��2H2�� SiO2��Na2CO3
Fe3O4��4H2 Fe +2Fe3+ = 3Fe2+ ���ɵİ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ�� Si��2NaOH��H2O ==Na2SiO3��2H2�� SiO2��Na2CO3![]() Na2SiO3��CO2��
Na2SiO3��CO2��
�����������������������Ҫ�������������赥�ʼ��仯��������ʡ�
��1��D������������A������B��������C������ƫ���������ڷ�Ӧ�����ӷ���ʽ��2Al��2OH����2H2O == 2 AlO![]() ��3H2�����ܷ�Ӧ�����ӷ���ʽ��AlO
��3H2�����ܷ�Ӧ�����ӷ���ʽ��AlO![]() ��CO2(����)��2H2O == Al(OH)3����HCO
��CO2(����)��2H2O == Al(OH)3����HCO![]() ��
��
��2��A����������ɫ���嵥����������A��ˮ��Ӧ�Ļ�ѧ����ʽ��3Fe��4H2O(g)![]() Fe3O4��4H2���ܷ�Ӧ�����ӷ���ʽ��Fe +2Fe3+ = 3Fe2+ ��D�м����������Ƶ����������ɵİ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��
Fe3O4��4H2���ܷ�Ӧ�����ӷ���ʽ��Fe +2Fe3+ = 3Fe2+ ��D�м����������Ƶ����������ɵİ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��
��3��A�ǹ裬C�ǹ����ƣ�D��̼���ƣ�һ����������ЧӦ����Ҫ�����Ƕ�����̼���ڷ�Ӧ�Ļ�ѧ����ʽ��Si��2NaOH��H2O ==Na2SiO3��2H2������B�Ƕ����������ݵĻ�ѧ����ʽΪSiO2��Na2CO3![]() Na2SiO3��CO2����
Na2SiO3��CO2����

����Ŀ�������£������й�������Һ��˵������ȷ����( )
��� | �� | �� |
pH | 12 | 12 |
��Һ | ��ˮ | ����������Һ |
A. �٢�����Һ��c(OH��)���
B. ����Һ�����ʵ���Ũ��Ϊ0.01mol��L-1
C. �٢�����Һ�ֱ��ˮϡ��10����ϡ�ͺ���Һ��pH����>��
D. ������Ģ٢�����Һ�ֱ���0.01mol��L-1��������ȫ�кͣ�����������������>��