题目内容
阿司匹林(乙酰水杨酸,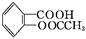 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
乙酸酐+水杨酸
 粗产品
粗产品
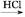
 乙酰水杨酸
乙酰水杨酸
(阿司匹林) 测熔点
测熔点
主要试剂和产品的物理常数
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是 。
(2)①合成阿司匹林时,最合适的加热方法是 。
②加热后冷却,未发现被冷却容器中有晶体析出,此时应采取的措施是 。
③抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(3)试剂A是 。
另一种改进的提纯方法如下:
粗产品
 乙酰水杨酸
乙酰水杨酸
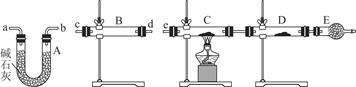
(4)改进的提纯方法中加热回流的装置如图所示,
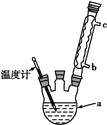
①使用温度计的目的是 。
②此种提纯方法中乙酸乙酯的作用是: ,所得产品的有机杂质要比原方案少,原因是 。
 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:乙酸酐+水杨酸
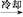
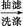 粗产品
粗产品
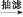
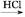
 乙酰水杨酸
乙酰水杨酸(阿司匹林)
 测熔点
测熔点主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是 。
(2)①合成阿司匹林时,最合适的加热方法是 。
②加热后冷却,未发现被冷却容器中有晶体析出,此时应采取的措施是 。
③抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(3)试剂A是 。
另一种改进的提纯方法如下:
粗产品
 乙酰水杨酸
乙酰水杨酸(4)改进的提纯方法中加热回流的装置如图所示,

①使用温度计的目的是 。
②此种提纯方法中乙酸乙酯的作用是: ,所得产品的有机杂质要比原方案少,原因是 。
(1)防止乙酸酐水解
(2)①水浴加热 ②振荡容器(或用玻璃棒搅拌;或用玻璃棒摩擦容器内壁;或投入几粒晶种)
③关小水龙头,向布氏漏斗中加洗涤剂(冰水)至浸没沉淀物,使洗涤剂缓慢通过沉淀物,重复操作2~3次
(3)NaHCO3
(4)①控制反应温度,防止温度过高,乙酰水杨酸受热分解
②作为重结晶的溶剂 水杨酸易溶于乙酸乙酯,在冷却结晶时大部分溶解在乙酸乙酯中,很少结晶出来
(2)①水浴加热 ②振荡容器(或用玻璃棒搅拌;或用玻璃棒摩擦容器内壁;或投入几粒晶种)
③关小水龙头,向布氏漏斗中加洗涤剂(冰水)至浸没沉淀物,使洗涤剂缓慢通过沉淀物,重复操作2~3次
(3)NaHCO3
(4)①控制反应温度,防止温度过高,乙酰水杨酸受热分解
②作为重结晶的溶剂 水杨酸易溶于乙酸乙酯,在冷却结晶时大部分溶解在乙酸乙酯中,很少结晶出来
(1)乙酸酐遇水极易反应生成乙酸,甚至发生爆炸,所以一定要干燥无水操作。(2)控制85~90℃的温度持续加热,最佳的方式是水浴加热。溶液形成过饱和溶液未析出晶体,是因为缺少晶种,可以采取措施是破坏过饱和状态,使晶体析出。因为制得的阿司匹林中含有水杨酸杂质,需要进行洗涤,为减少阿司匹林损失,则需要用冷水洗涤。(3)因为粗产品中含有水杨酸聚合物,所以先将阿司匹林转化为乙酰水杨酸钠可溶物,过滤除去水杨酸聚合物,加入试剂选择能溶解乙酰水杨酸但不与水杨酸聚合物反应的NaHCO3,若用NaOH,可能会导致乙酰水杨酸水解。(4)此分离方法中一要控制温度,防止温度过高乙酰水杨酸分解,二要加入有机溶剂溶解水杨酸,让乙酰水杨酸结晶析出。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
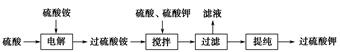
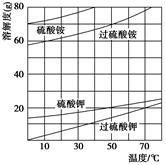
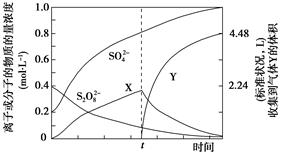
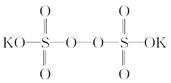 )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下: