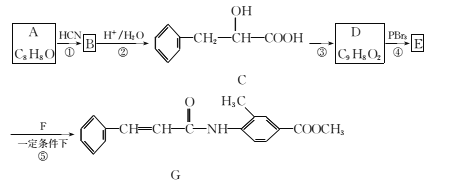
题目内容
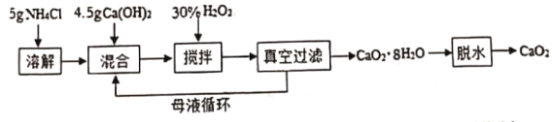
【题目】过氧化钙(CaO2)一种安全无的毒杀菌剂,以Ca(OH)2等为原料最终反应可制得CaO2。某化学研究性学习小组设计以下流程并探究不同条件对CaO2 制备的影响:
(1)搅拌过程中反应的化学反应方程式:___________________________。
(2)制备过界中除水外.可循环使用的物质是______________________。
(3)CaO2制备中H2O2合适的用量是__________________。
(4)该制备反应需控制温度在0~2℃,实验中可采取的措拖是 ___________ 。该温度下产率较高,其原因为__________________。
(5)CaO2样品中通常含有CaO,定量测定CaO2质量分数的实验方案为:_____。
(实验中可供选用的试剂有:氢氧化钠标准溶液、盐酸标准溶液、酚酞; 除常用仪器外须 使用的仪器有:电子天平、锥形瓶、滴定管)。
【答案】CaCl2+H2O2+2NH3H2O+6H2O═CaO28H2O↓+2NH4Cl NH4Cl 25mL 将反应器放置在冰水中 可防止氨水挥发、过氧化氢分解,以及CaO28H2O分解 用电子天平称取一定量的过氧化钙样品,然后加入过量的标准盐酸和样品反应,再向反应后的溶液中加入酚酞指示剂,用氢氧化钠标准溶液滴定
【解析】
由流程图可知,将氯化铵溶于水配成溶液,向氯化铵溶液中加入氢氧化钙,氯化铵与氢氧化钙反应生成一水合氨和氯化钙,在搅拌条件下,加入H2O2溶液,CaCl2与一水合氨、过氧化氢发生反应生成CaO28H2O,真空过滤得到CaO28H2O,CaO28H2O脱水制得CaO2。
(1)搅拌过程中,CaCl2与一水合氨、过氧化氢发生反应生成CaO28H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3H2O+6H2O═CaO28H2O↓+2NH4Cl,故答案为:CaCl2+H2O2+2NH3H2O+6H2O═CaO28H2O↓+2NH4Cl;
(2)由流程可知,开始用到氯化铵,制备CaO28H2O时又生成氯化铵,所以循环使用的物质是NH4Cl,故答案为:NH4Cl;
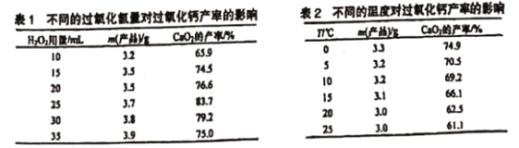
(3)由表1可知,加入25mL 20%的H2O2溶液时,过氧化钙的产率最高,则CaO2制备中H2O2合适的用量是25mL,故答案为:25mL ;
(4)若温度过高会造成氨水挥发、过氧化氢分解,还能使CaO28H2O分解,导致过氧化钙的产率降低,所以制备反应需控制温度在0~2℃,冰水混合物的温度是0℃,可将反应器放置在冰水中,故答案为:将反应器放置在冰水中;可防止氨水挥发、过氧化氢分解以及CaO28H2O分解;
(5)由题给试剂和仪器可知,定量测定CaO2质量分数应用电子天平称取一定量的过氧化钙样品,然后加入过量的标准盐酸和样品反应,再向反应后的溶液中加入酚酞指示剂,用氢氧化钠标准溶液滴定,故答案为:用电子天平称取一定量的过氧化钙样品,然后加入过量的标准盐酸和样品反应,再向反应后的溶液中加入酚酞指示剂,用氢氧化钠标准溶液滴定。

 阅读快车系列答案
阅读快车系列答案【题目】硼(B)及其化合物在化学工业中有诸多用途,请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B的化合价为_______________。
②工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4反应的另种产物为甲醇钠(CH3ONa),该反应的化学方程式为______________________。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为____________________。
(2)工业上以铁硼矿(主要成分为Mg2B2O5H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:
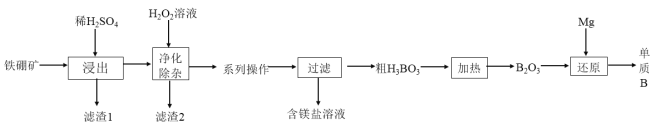
已知:相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 5.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 8.8 | 11 |
请回答下列问题:
①“浸出”时.将铁硼矿石粉碎的目的为___________________________。写出Mg2B2O5H2O与硫酸反应的化学方程式:____________________。
②滤渣1的主要成分为_____________________________。
③“净化除杂”时需先加H2O2溶液,其目的为_______________,然后再调节溶液的pH≈5,其目的是___________________________________。
④制得的粗硼在一定条件下能生成BI3 , BI3加热分解可以得到纯净的单质硼。现将0.025 g粗硼制成的BI3完全分解,生成的I2用0.30 molL-1 Na2S2O3溶液滴定(I2 +2S2O32-=2I-+ S4O6 2-)至终点,消耗 18.00 mLNa2S2O3溶液:盛装Na2S2O3溶液应用_____________填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为________________。
【题目】(1)已知常温时,0.1 mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=__,醋酸的电离平衡常数K=__。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
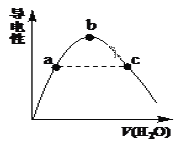
① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-) __c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8 | Ka1=4.3 | Ka=3.0 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________。