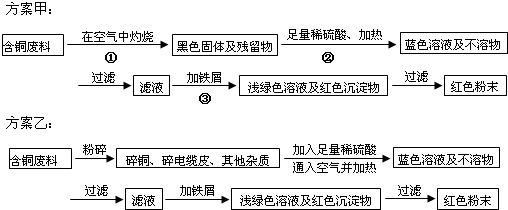
题目内容
Ⅰ.请同学们认真并仔细地观察下面两种电池的构造示意图,回答下列问题:

(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O![]() 2MnOOH+Zn(OH)2,则负极的电极反应式为________.
2MnOOH+Zn(OH)2,则负极的电极反应式为________.
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大.试从影响反应速率的因素分析其原因是________.
Ⅱ.设计电池是原电池原理的重要应用.现有如下两个反应:
(A)NaOH+HCl![]() NaCl+H2O
NaCl+H2O
(B)2FeCl3+Cu![]() 2FeCl2+CuCl2
2FeCl2+CuCl2
(1)根据两个反应的本质,判断能否设计成原电池(A)________(填“能”或“否”,下同),(B)________.
(2)如果不能,说明其原因:________.
(3)如果可以,装置可采用烧杯和盐桥,请画出原电池的装置图并注明正、负极材料.
答案:
解析:
解析:
|
Ⅰ. (1)Zn+2OH--2e-(2)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大 Ⅱ. (1)否 能(2)(A)是一个非氧化还原反应 (3)左右两半池中的溶液只要是分别含有Cu2+、Fe3+的溶液均可以,如图:
|

练习册系列答案
相关题目