题目内容
(2012?珠海一模)某化学研究性小组同学提出回收含铜电缆废料中提取铜的两种方案,并向专家咨询,专家就以下几个方面与同学们展开讨论:
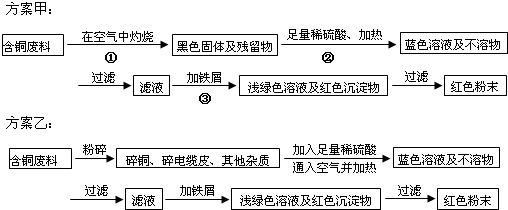
(1)两个方案哪个符合当前生产的绿色理念,为什么?
(2)方案甲中的②③步骤与铜有关的反应是离子反应吗?若是,写出离子方程式.
(3)专家建议,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,目的是:
(4)专家请同学们用简便的方法检验红色粉末中是否含有过量的铁屑,同学们运用所学的知识提出了几种方案,请你写出其中的一种方案.
(5)为了提高原料的利用率,专家建议把最后一步所得浅绿色滤液通过蒸发、冷却结晶、
①先取a g的晶体进行脱水实验,获得无水固体为(a-1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全.
研究小组通过计算测知该晶体的化学式是

(1)两个方案哪个符合当前生产的绿色理念,为什么?
乙;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾
乙;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾
.(2)方案甲中的②③步骤与铜有关的反应是离子反应吗?若是,写出离子方程式.
②CuO+2H+═Cu2++H2O③Fe+Cu2+═Fe2++Cu
②CuO+2H+═Cu2++H2O③Fe+Cu2+═Fe2++Cu
.(3)专家建议,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,目的是:
确保Cu完全置换出来
确保Cu完全置换出来
.(4)专家请同学们用简便的方法检验红色粉末中是否含有过量的铁屑,同学们运用所学的知识提出了几种方案,请你写出其中的一种方案.
可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生)
可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生)
.(5)为了提高原料的利用率,专家建议把最后一步所得浅绿色滤液通过蒸发、冷却结晶、
过滤
过滤
、洗涤、自然干燥得到一种带结晶水的硫酸亚铁晶体.研究小组按专家的建议完成上面操作步骤,获得晶体后对其进行检测①先取a g的晶体进行脱水实验,获得无水固体为(a-1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全.
研究小组通过计算测知该晶体的化学式是
FeSO4?7H2O
FeSO4?7H2O
.分析:(1)生产的绿色理念是指对环境无污染的理念;
(2)有离子参加的反应是离子反应,根据氧化铜和酸以及金属铁和铜离子之间的置换反应来回答;
(3)为了保障全部金属Cu被置换出来,加入的试剂要过量;
(4)铁可以被磁铁吸引;
(5)溶液获得晶体的方法:蒸发、冷却结晶、过滤、洗涤、自然干燥,根据结晶水合物分解的方程式和钡离子与硫酸根离子间的反应来计算结晶水的数目.
(2)有离子参加的反应是离子反应,根据氧化铜和酸以及金属铁和铜离子之间的置换反应来回答;
(3)为了保障全部金属Cu被置换出来,加入的试剂要过量;
(4)铁可以被磁铁吸引;
(5)溶液获得晶体的方法:蒸发、冷却结晶、过滤、洗涤、自然干燥,根据结晶水合物分解的方程式和钡离子与硫酸根离子间的反应来计算结晶水的数目.
解答:解:(1)乙方案对环境不会造成污染,符合当前生产的绿色理念,而甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾,不符合绿色理念,故答案为:乙;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾;
(2)方案甲中的②③步骤与铜有关的反应分别是:②CuO+2 H+═Cu2++H2O,③Fe+Cu2+═Fe2++Cu,均含有离子参与的反应,是离子反应,故答案为:②CuO+2H+═Cu2++H2O③Fe+Cu2+═Fe2++Cu;
(3)为了保障全部金属Cu被置换出来,加入的试剂铁要过量,故答案为:确保Cu完全置换出来;
(4)根据金属铁的性质:可以被磁铁吸引,可以和酸反应生成氢气,故答案为:可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生);
(5)硫酸亚铁溶液经过蒸发、冷却结晶、过滤、洗涤、自然干燥就会得到一种带结晶水的硫酸亚铁晶体,
根据反应FeSO4?xH2O
FeSO4+xH2O
a a-1.26 1.26
无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全,即消耗钡离子的物质的量是0.01mol时,沉淀完全,所以硫酸亚铁的物质的量是0.01mol,分解生成水的质量是0.01xmol,所以0.18x=1.26,解得x=7,所以分子式为:FeSO4?7H2O.
故答案为:过滤;FeSO4?7H2O.
(2)方案甲中的②③步骤与铜有关的反应分别是:②CuO+2 H+═Cu2++H2O,③Fe+Cu2+═Fe2++Cu,均含有离子参与的反应,是离子反应,故答案为:②CuO+2H+═Cu2++H2O③Fe+Cu2+═Fe2++Cu;
(3)为了保障全部金属Cu被置换出来,加入的试剂铁要过量,故答案为:确保Cu完全置换出来;
(4)根据金属铁的性质:可以被磁铁吸引,可以和酸反应生成氢气,故答案为:可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生);
(5)硫酸亚铁溶液经过蒸发、冷却结晶、过滤、洗涤、自然干燥就会得到一种带结晶水的硫酸亚铁晶体,
根据反应FeSO4?xH2O
| ||
a a-1.26 1.26
无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全,即消耗钡离子的物质的量是0.01mol时,沉淀完全,所以硫酸亚铁的物质的量是0.01mol,分解生成水的质量是0.01xmol,所以0.18x=1.26,解得x=7,所以分子式为:FeSO4?7H2O.
故答案为:过滤;FeSO4?7H2O.
点评:本题是一道考查金属铜以及其化合物性质知识的综合题,要求学生具有分析和解决问题的能力,难度很大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目