题目内容
11.用已知物质的量浓度的盐酸滴定未知物质的量浓度的氢氧化钠溶液,下列操作会导致测定结果偏高的是( )| A. | 用标准的盐酸溶液润洗酸式滴定管2-3次 | |
| B. | 用待测碱液润洗碱式滴定管2-3次 | |
| C. | 用待测碱液润洗锥形瓶2-3次 | |
| D. | 用蒸馏水润洗锥形瓶2-3次 |
分析 酸碱中和的本质是H++OH-=H2O,故用盐酸滴定未知浓度的氢氧化钠溶液是存在V(HCl)×c(HCl)=V(NaOH)×c(NaOH),误差分析时可根据操作情况导致标准液的体积的变化来推测未知液的浓度变化,据此可判断;
A.酸式滴定管应先用水洗,再用标准溶液润洗酸式滴定管2-3次;
B.碱式滴定管应先用水洗,再用所要盛装的碱溶液润洗碱式滴定管2-3次;
C.锥形瓶只能水洗,不能用所盛溶液润洗;
D.锥形瓶只能水洗,不能用所盛溶液润洗.
解答 解:A.用标准的盐酸溶液润洗酸式滴定管2-3次,符合操作规范,不影响滴定结果,故A不选;
B.用待测碱液润洗碱式滴定管2-3次,操作正确,对实验结果无影响,故B不选;
C.用待测碱液润洗锥形瓶2-3次,间接增加了待测溶液的体积,消耗标准盐酸溶液体积增大,导致测定浓度增大,故C选;
D.用蒸馏水润洗锥形瓶2-3次,对待测溶液里的氢氧化钠的物质的量没有影响,即不影响测定结果,故D不选;
故选C.
点评 本题考查了化学实验方案评价,涉及实验误差分析,注意:A中滴定管和量筒数值的区别、C中锥形瓶是否需要润洗,这些都是易错点

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
2.CoCl2•6H2O在饲料、医药工业上有广泛的用途.下列是以含钴废料(含少量Fe、Al等杂质)为原料制取CoCl2•6H2O的一种新工艺流程如图1:
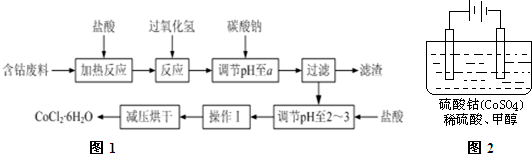
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)加入碳酸钠调节pH至a,a的范围是5.2~7.6.
(2)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(3)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(4)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染、防止产品中混有硝酸盐.原工艺较新工艺也有优点,其主要优点是流程的步骤减小,工艺减化.
(5)含钴物质在工业上有重要用途,有一种电化学法除去甲醇的污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中甲醇氧化成CO2而净化.实验室用如图2装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+.
②除去甲醇的离子反应为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是碳元素,当生产过程中产生标况下2.24LCO2时,共转移电子数为3.612×1023.

已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.5 | 7.6 | 3.8 |
| 完全沉淀 | 3.2 | 9.7 | 9.2 | 5.2 |
(1)加入碳酸钠调节pH至a,a的范围是5.2~7.6.
(2)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(3)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(4)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染、防止产品中混有硝酸盐.原工艺较新工艺也有优点,其主要优点是流程的步骤减小,工艺减化.
(5)含钴物质在工业上有重要用途,有一种电化学法除去甲醇的污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中甲醇氧化成CO2而净化.实验室用如图2装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+.
②除去甲醇的离子反应为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是碳元素,当生产过程中产生标况下2.24LCO2时,共转移电子数为3.612×1023.
16.下列说法正确的是( )
①木材纤维和土豆淀粉遇碘水均显蓝色
②食用花生油和鸡蛋清都能发生水解反应
③包装用材料聚乙烯和聚氯乙烯都属于烃
④PX项目的主要产品对二甲苯属于芳香烃
⑤金属钠着火时使用泡沫灭火器灭火
⑥用试管加热碳酸氢钠固体时使试管呈四十五度倾斜
⑦浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
⑧制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片.
①木材纤维和土豆淀粉遇碘水均显蓝色
②食用花生油和鸡蛋清都能发生水解反应
③包装用材料聚乙烯和聚氯乙烯都属于烃
④PX项目的主要产品对二甲苯属于芳香烃
⑤金属钠着火时使用泡沫灭火器灭火
⑥用试管加热碳酸氢钠固体时使试管呈四十五度倾斜
⑦浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
⑧制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片.
| A. | ①④⑥ | B. | ②⑤⑦ | C. | ②④⑧ | D. | ①⑦⑧ |
1.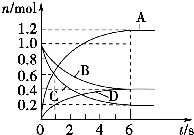 一定温度下,向容积为2L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断不合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断不合理的是( )
 一定温度下,向容积为2L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断不合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断不合理的是( )| A. | 该反应的化学方程式为3B+4C?6A+2D | |
| B. | 反应进行到1 s时,v(A)和v(D)不相等 | |
| C. | 反应进行到6 s时,B的平均反应速率为0.05 mol•L-1•s-1 | |
| D. | 反应进行到6 s时,各物质的浓度不再变化,反应速率为零 |
 A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同.已知:2NO2(g)?N2O4(g)△H<0.
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同.已知:2NO2(g)?N2O4(g)△H<0. 1,2,3,4-四氢化萘的结构简式是
1,2,3,4-四氢化萘的结构简式是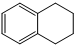 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下: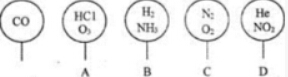 取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,吹出体积相等的状况,如图所示.A、B、C、D四个气球内,与CO所含原子数一定相等的是( )
取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,吹出体积相等的状况,如图所示.A、B、C、D四个气球内,与CO所含原子数一定相等的是( ) (Ⅰ)已知标准状况下,将1.12升氯化氢通入水中配成100毫升溶液,试计算:
(Ⅰ)已知标准状况下,将1.12升氯化氢通入水中配成100毫升溶液,试计算: