题目内容
【题目】常温下,向![]() 和NaOH混合溶液中缓慢通入
和NaOH混合溶液中缓慢通入![]() 至过量
至过量![]() 溶液温度变化忽略不计
溶液温度变化忽略不计![]() ,生成沉淀物质的量与通入
,生成沉淀物质的量与通入![]() 体积的关系如图所示。下列说法不正确的是
体积的关系如图所示。下列说法不正确的是![]()
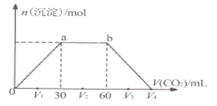
A.b点时溶质为![]()
B.横坐标轴上![]() 的值为90
的值为90
C.![]() 、
、![]() 、
、![]() 时,溶液
时,溶液![]() 中相等
中相等
D.原混合物中![]() :
:![]() ;2
;2
【答案】D
【解析】
向NaOH和![]() 的混合稀溶液中通入
的混合稀溶液中通入![]() ,开始立即产生沉淀,故a点之前发生反应:
,开始立即产生沉淀,故a点之前发生反应:![]() 之间先发生反应:
之间先发生反应:![]() ,再发生反应:
,再发生反应:![]() 之后发生反应:
之后发生反应:![]() 。
。
A.由上述分析可知,b点时溶质为![]() ,选项A正确;
,选项A正确;
B.由方程式可知生成碳酸钡沉淀与碳酸钡溶解消耗二氧化碳的体积相等,可知![]() 的值为:
的值为:![]() ,选项B正确;
,选项B正确;
C.碳酸钡的溶度积在一定温度下为定值,故![]() 、
、![]() 、
、![]() 时,溶液
时,溶液![]() 中相等,选项C正确;
中相等,选项C正确;
D.氢氧化钡、氢氧化钠消耗二氧化碳体积分别为30L、![]() ,结合方程式可知,溶液中
,结合方程式可知,溶液中![]() 和NaOH的浓度之比为1:1,选项D错误。
和NaOH的浓度之比为1:1,选项D错误。
答案选D。

练习册系列答案
相关题目