题目内容
8.海洋是一个远未完全开发的巨大化学资源宝库,从海水中可得到多种化工原料和产品.Ⅰ.海水中含有氯化镁,是镁的重要来源之一.从海水中制取镁,某同学设计了如下流程步骤:

(1)写出向海水中加入石灰乳后发生反应的离子方程式:Mg2++Ca(OH)2=Mg(OH)2+Ca2+.
(2)下列说法不正确的是bc(填代号)
a.此法的优点之一是原料来源丰富
b.电解 MgCl2溶液制镁是由于镁是很活泼的金属
c.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应.
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯.此电池负极的电极反应为Al-3e-=Al3+.
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法.将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先用水润湿),并架在铁架台上,下面放置一个盛有沙子的蒸发皿.请写出引发铝热反应的操作在铝热剂的上面加少量KClO3,中间插上镁条并将其点燃.
(3)为确定某铝热剂(氧化铁粉末和铝粉)中铝的质量分数,进行下列实验.若取 10.8g 样品,向其中加入足量的 NaOH 溶液,测得生成的气体(标准状况)体积为 3.36L,样品中铝的质量分数是25%.
分析 Ⅰ、(1)向海水中加入石灰乳后反应生成氢氧化镁沉淀和氯化钙,石灰乳不能写成离子形式;
(2)从海水中制取镁主要存在以下的转化过程:MgCl2 $\stackrel{石灰乳}{→}$Mg(OH)2 $\stackrel{盐酸蒸发浓缩}{→}$MgCl2•6H2O$\stackrel{HCl气流中加热}{→}$MgCl2 $\stackrel{通电}{→}$Mg,利用此过程所涉及的反应和相关信息得出正确结论;
Ⅱ、(1)原电池工作时,铝为负极,被氧化,电极方程式为Al-3e-=Al3+;
(2)Fe2O3与Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,引发铝热反应是用铝热剂的上面加少量KClO3,中间插上镁条并将其点燃,氧化铁和铝之间发生反应生成金属铁和氧化铝,反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)铝和NaOH反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2)=0.15mol,根据化学方程式计算.
解答 解:Ⅰ、(1)向海水中加入石灰乳后反应生成氢氧化镁沉淀和氯化钙,石灰乳不能写成离子形式,反应的离子方程式为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+,
故答案为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+;
(2)a、原料来源于海水,故原料来源丰富,故a正确;
b、镁是很活泼的金属,可用电解熔融氯化镁的电解法制得,电解氯化镁溶液不能得到金属镁,故b错误;
c、①为分解反应和化合反应,②为复分解反应,③为复分解反应,④为分解反应,整个变化过程中无置换反应,故c错误,
故答案为:bc;
Ⅱ、(1)负极发生氧化反应,Al失去电子生成铝离子,电极反应式为:Al-3e-═Al3+,原电池工作时,电子从负极经外电路流向正极,
故答案为:Al-3e-=Al3+;
(2)Fe2O3与Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,方程式为:2Al+Fe2O3═2Fe+Al2O3,引发铝热反应的实验操作是在铝热剂的上面加少量KClO3,中间插上镁条并将其点燃,
故答案为:在铝热剂的上面加少量KClO3,中间插上镁条并将其点燃;
(3)铝和NaOH反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2)=0.15mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
n(Al) 0.15mol
n(Al)=0.1mol,
m(Al)=27g/mol×0.1mol=2.7g,
ω(Al)=$\frac{2.7g}{10.8g}$×100%=25%,
故答案为:25%.
点评 本题考查铝热反应以及化学方程式的计算,题目难度中等,本题注意铝热反应的原理,注意相关方程式的书写以及物质的量应用于化学方程式的计算方法.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案| A. | 使石蕊试液呈紫色的溶液 | |
| B. | c(H+)=c(OH-)=10-6mol/L溶液 | |
| C. | pH=7的溶液 | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
| A. | 通入大量 NO,ν 正、ν 逆 均增大 | |
| B. | 恒温恒容下充入 Ne,ν 正、ν 逆 均不变 | |
| C. | ν 正(NO)=2ν 逆(N2)时,反应达到平衡 | |
| D. | n (NO):n (CO):n (N2):n (CO2)=2:2:1:2 时,反应达到平衡 |
| A. | 体心立方是金属最密堆积的形式 | |
| B. | 在SiO2晶体中,并不存在单个“SiO2”分子 | |
| C. | 干冰中,与CO2分子等距紧邻的CO2分子有8个 | |
| D. | 31 g P4含有P-P键的个数为4NA |
| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 氧化反应 |
| A. | 0.1mol/L pH=9的NaNO2溶液中C(Na+)>C(NO2-)>C(OH-)>C(H+) | |
| B. | 0.1mol/LNa2S溶液中:2C(Na+)=C(S2-)+C(HS-)+C(H2S) | |
| C. | 等PH的氨水、NaOH溶液、Ba(OH)2溶液中:C(NH4+)=C(Na+)=C(Ba2+) | |
| D. | 向NH4HCO3溶液中滴加NaOH溶液至pH=7:C(NH4+)+C(Na+)=C(HCO32-)+C(CO32-) |
| A. | 矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快 | |
| B. | 接触室中采用常压的主要原因是常压下SO2的转化率已经很高 | |
| C. | 沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒 | |
| D. | 接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量 |
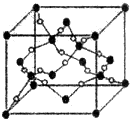 A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.
A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.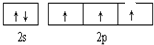 ,与AC3分子互为等电子体的阳离子为H3O+;
,与AC3分子互为等电子体的阳离子为H3O+;