题目内容
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取Al2O3的两种工艺流程如下:
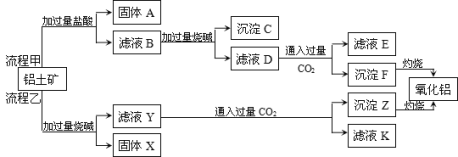
请回答下列问题:
(1)流程甲加入盐酸后生成Fe3+的离子方程式为________________;
(2)铝土矿中固体A 是__________(填化学式),写出沉淀F转化为氧化铝的化学方程式_____________;
(3)流程乙中,写出滤液Y 与过量CO2反应生成沉淀Z的离子方程式为________________________;
(4)固体X 是__________________(填化学式)
(5)利用铝热反应原理,写出有Cr2O3制备Cr的化学方程式_________________________________。
【答案】Fe2O3+6H+=2Fe3++3H2O SiO2 2Al(OH)3![]() Al2O3+3H2O AlO2-+CO2+H2O= Al(OH)3↓+HCO3-和SiO32-+2CO2+2H2O= H2SiO3↓+2HCO3- Fe2O3 和MgO Cr2O3+2 Al
Al2O3+3H2O AlO2-+CO2+H2O= Al(OH)3↓+HCO3-和SiO32-+2CO2+2H2O= H2SiO3↓+2HCO3- Fe2O3 和MgO Cr2O3+2 Al![]() Al2O3+2Cr
Al2O3+2Cr
【解析】
由题给工艺流程甲可知,铝土矿与过量盐酸反应得固体A和滤液B,二氧化硅与盐酸不反应,氧化铝、氧化铁和氧化镁溶于盐酸,则固体A为SiO2,滤液B中含有氯化铝、氯化铁、氯化镁等;向滤液中加入过量的NaOH溶液,依据氢氧化铝的性质可知,沉淀C中含有氢氧化铁和氢氧化镁,滤液D中含有偏铝酸钠和氯化钠;向滤液D中通入过量二氧化碳,二氧化碳与偏铝酸钠溶液反应生成氢氧化铝沉淀与碳酸氢钠,则沉淀F为Al(OH)3,滤液E中含有NaCl和NaHCO3;根据工艺流程乙可知,铝土矿与过量氢氧化钠反应反应得固体X和滤液Y,氧化铁和氧化镁与氢氧化钠溶液不反应,氧化铝和二氧化硅溶于氢氧化钠溶液,则固体X为Fe2O3和MgO,滤液Y中含有硅酸钠和偏铝酸钠;向滤液中通入过量二氧化碳,过量二氧化碳与硅酸钠和偏铝酸钠反应生成氢氧化铝、硅酸沉淀和碳酸氢钠,则沉淀Z中含有Al(OH)3和硅酸,滤液K中含有NaHCO3,
(1)流程甲中加入盐酸,铝土矿中Fe2O3与盐酸反应生成氯化铁和水,反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)铝土矿中固体A 是不与盐酸反应的酸性氧化物二氧化硅,化学式为SiO2;氢氧化铝沉淀灼烧分解生成氧化铝和水,反应的化学方程式为2Al(OH)3![]() Al2O3+3H2O,故答案为:SiO2;2Al(OH)3
Al2O3+3H2O,故答案为:SiO2;2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(3)流程乙中,滤液Y中硅酸钠和偏铝酸钠与过量二氧化碳反应生成氢氧化铝、硅酸沉淀和碳酸氢钠,反应的离子方程式为AlO2-+CO2+H2O= Al(OH)3↓+HCO3-和SiO32-+2CO2+2H2O= H2SiO3↓+2HCO3-,故答案为:AlO2-+CO2+H2O= Al(OH)3↓+HCO3-和SiO32-+2CO2+2H2O= H2SiO3↓+2HCO3-;
(4)流程乙中,铝土矿与过量氢氧化钠反应反应得固体X和滤液Y,氧化铁和氧化镁与氢氧化钠溶液不反应,氧化铝和二氧化硅溶于氢氧化钠溶液,则固体X为Fe2O3和MgO,故答案为:;Fe2O3和MgO;
(5)Cr2O3与Al高温条件下发生铝热反应生成Al2O3与Cr,反应的化学方程式为Cr2O3+2 Al![]() Al2O3+2Cr,故答案为:Cr2O3+2 Al
Al2O3+2Cr,故答案为:Cr2O3+2 Al![]() Al2O3+2Cr。
Al2O3+2Cr。

 名校课堂系列答案
名校课堂系列答案【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 最外层电子数是电子层数的两倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,该核素的原子核内有8个中子,则这种同位素的符号是________。
(2)元素Y的单质的电子式为_________________,元素Y和元素Z可形成一种各原子最外层均为8电子结构的化合物,该化合物的结构式为 ___________
(3)元素X与元素T相比,非金属性较强的是元素T,下列表述中不能证明这一事实的选项是_____。
a.常温下元素X的单质和元素T的单质的熔沸点不同
b.元素T的氢化物比元素X的氢化物稳定
c.元素X和元素T的单质都能在氧气中燃烧
d.元素T最高价氧化物对应水化物的酸性比元素X最高价氧化物对应水化物的酸性强
e.Na2XO3溶液呈碱性,Na2TO4溶液呈中性
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种酸的是_______________(用化学式表示)
【题目】(1)在某一容积为2 L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:

回答下列问题:
①该反应的化学方程式为__________________________________。
②前2 min用A的浓度变化表示的化学反应速率为________。在2 min时,图像发生改变的原因是________(填字母)。
A.增大压强 B.降低温度 C.加入催化剂 D.增加A的物质的量
(2)在100 ℃时,将0.01 mol的四氧化二氮气体充入0.1 L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式________________________________,达到平衡时四氧化二氮的转化率为_______。
②在0~20 s内,四氧化二氮的平均反应速率为______,哪一时间段______(指0~20、20~40、40~60、60~80、80~100 s)反应速率最大并解释______。

