题目内容
将0.2 mol·L-1的HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
| A.c(HCN)<c(CN-) | B.c(Na+)> c(CN-) |
| C.c(HCN)=c(CN-)= c(Na+) | D.c(HCN)+c(CN-)="0.2" mol·L-1 |
B
解析试题分析:HCN和NaOH反应后得到等浓度的HCN和NaCN的混合溶液。HCN是弱酸,电离是溶液显酸性。NaCN水解使溶液显碱性。现在溶液显碱性说明CN-的水解作用大于HCN的电离作用。所以c(CN-)<c(HCN);c(Na+)> c(CN-); c(HCN)+c(CN-)= 2c(Na+) ;c(HCN)+c(CN-)="0.2" mol/L÷2="0.1" mol/L.选项为:B。
考点:考查弱酸的电离及其相应的盐的水解、溶液中离子浓度的大小比较的知识。

练习册系列答案
相关题目
已知Ksp(AgCl)=1.8×10—10mol2?L—2,Ksp(AgI)=1.0×10—16mo2?L—2。下列说法错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.在含浓度均为0.001mol?L—1的Cl—、I—的溶液中缓慢滴AgNO3稀溶液,先析出AgI |
| C.AgI比AgCl更难溶于水,所以AgCl可转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10—11mol?L—1 ×10—11mol?L—1 |
0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是
| A.c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| B.c(K+)+ c(S2-) = 0.3mol/L |
| C.c(K+)=c(S2-)+c(HS-)+c(H2S) |
| D.c(OH-)=c(H+)+c(HS-)+2c(H2S) |
常温下,向20.00mL 0.1000 mol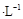 (NH4)2 SO4溶液中逐滴加入0.2000 mol
(NH4)2 SO4溶液中逐滴加入0.2000 mol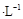 NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
下列说法正确的是
| A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C.点c所示溶液中:c(SO42)+ c(H+)= c(NH3·H2O )+ c(OH-) |
| D.点d所示溶液中:c(SO42)>c(NH3·H2O )>c(OH-)>c(NH4+) |
下列叙述正确的是
| A.0.1mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等 |
D.在NaHCO3溶液中:c(OH-)+c( )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
| A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小 |
| B.三个不同温度中,363K时Ksp(SrSO4)最大 |
| C.283K时,图中a点对应的溶液是不饱和溶液 |
| D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
室温下,下列溶液中c(H+)最小的是
| A.c(OH-)=1×10-11mol·L-1 | B.pH=3的CH3COOH溶液 |
| C.pH=4的H2SO4溶液 | D.c(H+)=1×10-3mol·L-1 |
下列叙述正确的是
| A.95 ℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.0.2 mol·L-1的盐酸,与等体积水混合后pH=1 |
| D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断一定正确的是
| A.c(A-)≧c(M+) |
| B.c(A-)= c(M+) |
| C.若MA不水解,则c(OH-)<c(H+) |
| D.若MA水解,则c(OH-)>c(H+) |