题目内容
18.用A、B二石墨电极电解AgNO3溶液,通电t min时,在B极上共收集11.2mL标况气体.然后反接电源,用相同电流再电解$\frac{t}{2}$min,两极上均无气体产生,最终溶液的体积为200mL,则该溶液的pH值接近2.分析 用A、B二石墨电极电解AgNO3溶液,在阳极上析出的是氧气,在阴极上产生的是金属银,在B极上共产生11.2mL(标准状况下)气体即为氧气的体积,将电极A、B与电反接,在阳极上是金属银失电子,在阴极上是银离子得电子析出金属银,不会影响pH的变化.
解答 解:惰性电极电解硝酸银溶液,阳极是溶液中氢氧根离子放电生成氧气,4OH--4e-=2H2O+O2↑,阴极上是溶液中银离子得到电子生成银,电极反应为:Ag++e-=Ag,在B极产生的是氧气,在B极上共产生11.2mL即0.0005mol氧气,根据电极反应:4OH--4e-=2H2O+O2↑,则减少的氢氧根离子的物质的量是0.002mol,溶液中氢离子的物质的量是0.002mol,浓度是$\frac{0.002mol}{0.2L}$=0.01mol/L,即pH=2,将电极A、B与电反接,在阳极上是金属银失电子,在阴极上是银离子得电子析出金属银,不会影响pH的变化,
故答案为:2.
点评 本题考查学生电解原理的应用和计算知识,注意电极反应式的书写以及电子守恒的计算知识,题目难度中等.

练习册系列答案
相关题目
18.有机物 可以由某种含有一个双键的烯烃加成得到,则该烯烃的结构可能有( )
可以由某种含有一个双键的烯烃加成得到,则该烯烃的结构可能有( )
 可以由某种含有一个双键的烯烃加成得到,则该烯烃的结构可能有( )
可以由某种含有一个双键的烯烃加成得到,则该烯烃的结构可能有( )| A. | 一种 | B. | 三种 | C. | 四种 | D. | 八种 |
6.已知草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.如图是利用饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11-0℃.
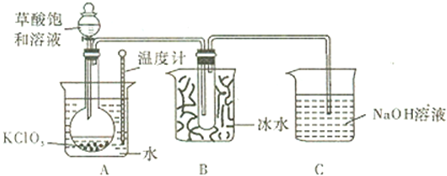
(1)该反应的反应原理如下,试配平该化学方程式:2KClO3+1 H2C2O4═2KHCO3+2ClO2↑
(2)B装置的作用是将ClO2冷凝收集.
(3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因:原因I:过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O;原因II:因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请在答题卷上写出实验步骤以及预期现象和结论.限选实验试剂:1mol•L-1 H2SO4溶液、0.1mol•L-l盐酸、0.01mol•L-1 KMnO4溶液、澄清石灰水.

(1)该反应的反应原理如下,试配平该化学方程式:2KClO3+1 H2C2O4═2KHCO3+2ClO2↑
(2)B装置的作用是将ClO2冷凝收集.
(3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因:原因I:过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O;原因II:因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请在答题卷上写出实验步骤以及预期现象和结论.限选实验试剂:1mol•L-1 H2SO4溶液、0.1mol•L-l盐酸、0.01mol•L-1 KMnO4溶液、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量0.1mol•L-1盐酸 | 沉淀全部溶解,有气泡产生,说明沉淀中有碳酸钙 |
| 步骤2:往步骤1的剩余物中,再滴加几滴0.01mol•L-1 KmnO4溶液 | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
3.化学与生活密切相关,下列说法不正确的是( )
| A. | 用热的纯碱溶液可洗涤餐具上的油污 | |
| B. | 新型氢动力汽车的使用可减少雾霾的产生 | |
| C. | 钢铁厂用热还原法冶炼铁 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
10.下列说法正确的是( )
| A. | 银氨溶液可以用于区分葡萄糖和麦芽糖 | |
| B. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| C. | 对苯二酚和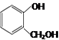 互为同系物 互为同系物 | |
| D. | 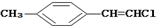 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
8.恒温下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
| A. | 保持容器体积不变,充入1molSO3(g) | |
| B. | 保持容器内压强不变,充入1molSO3(g) | |
| C. | 保持容器体积不变,充入1molO2(g) | |
| D. | 保持容器内压强不变,充入1molAr(g) |
 氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇.
氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇.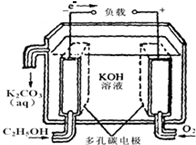 (1)广州是一座美丽的海滨城市,海水资源非常丰富.海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3,下列说法正确的是bc(填写序号字母);
(1)广州是一座美丽的海滨城市,海水资源非常丰富.海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3,下列说法正确的是bc(填写序号字母);