题目内容
【题目】如图是可逆反应2A(g)+2B(g)![]() 2C(g)+3D(g)(正反应ΔH>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图。下列条件的改变与图中情况相符的是( )
2C(g)+3D(g)(正反应ΔH>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图。下列条件的改变与图中情况相符的是( )
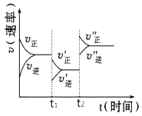
A.t1时,减小了A或B的物质的量浓度
B.t2时,升高了温度
C.t2时,增大了压强
D.t1时,加了催化剂
【答案】B
【解析】
A选项,t1时,减小A或B的物质的量浓度,正反应速率立即减小,逆反应速率暂时不变,随之减小,故A不与图中情况相符,不符合题意;
B选项,t2时,升高了温度,吸热反应影响大即正反应速率增加得多,放热反应速率增加得少,平衡向吸热反应即正向移动,故B与图中情况相符,符合题意;
C选项,t2时,增大了压强,系数大的影响大即逆反应增加得多,故C不与图中情况相符,不符合题意;
D选项,t1时,加了催化剂,正反应速率和逆反应速率改变程度相同,故D不与图中情况相符,不符合题意;
综上所述,答案为B。

【题目】I.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出基态Zn2+的核外电子排布式:_____,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花 _____s。
II.某可逆反应在某体积为5 L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X
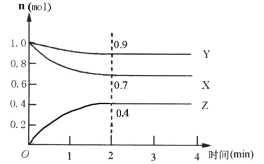
(3)该反应的的化学方程式为__________________;
(4)反应开始至2分钟时,X的平均反应速率为__;
(5)能说明该反应已达到平衡状态的是_________;
a.每消耗1molX,同时生成1.33molZ b.容器内压强保持不变
c.Z的浓度不再变化 d.容器内混合气体的密度保持不变
(6)由下图求得平衡时Y的转化率为__________________。
(7)若保持容器体积不变,充入He,容器内反应速率将_______。(填“增大”“减小”或“不变”)
【题目】完成下列填空:
(1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,写出N2和H2反应的热化学方程式:____________________.

(2)若已知下列数据:试根据表中及图中数据计算N-H的键能____________kJ·mol-1.
化学键 | H-H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1___________,E2 _________ (填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如4NH3(g)+3O2(g)=2N2(g)+6H2O(g);ΔH1= a kJ·mol-1N2(g)+O2(g)=2NO(g);ΔH2=b kJ/mol若1mol NH3还原NO至N2,写出该反应的热化学方程式__________(ΔH用a、b表示).
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2 mL 0.1mol/L的FeCl3溶液中加足量铁粉,振荡,加2滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 在稀AgNO3溶液中先加入足量0.1mol/L NaCl溶液,再加入少量0.1mol/L NaI溶液 | 先产生白色沉淀,后出现黄色沉淀 | 说明Ksp(AgCl)>Ksp(AgI) |
C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 常温下,测定等物质的量浓度的Na2CO3和Na2SO4溶液的pH值 | 前者的 pH值比后者的大 | 非金属性:S>C |
A. AB. BC. CD. D


