题目内容
【题目】根据事实,写出298K时下列反应的热化学方程式:
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为__。
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3kJ热量。___。
(3)家用液化气中主要成分之一是丁烷。当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ。试写出丁烷燃烧反应的热化学方程式___。
(4)1molHgO(s)分解为液态汞和氧气,吸热90.7kJ。__。
【答案】B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=2165kJ/mol C(s)+ H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol C4H10(g)+![]() O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol HgO(s)=Hg(l)+
O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol HgO(s)=Hg(l)+![]() O2(g) △H=+90.7kJ/mol
O2(g) △H=+90.7kJ/mol
【解析】
(1)1mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出的热量为![]() ,热化学方程式为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=2165kJ/mol,故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=2165kJ/mol;
,热化学方程式为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=2165kJ/mol,故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=2165kJ/mol;
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3kJ热量,热化学方程式为:C(s)+ H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol,故答案为:C(s)+ H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol;
(3)1g丁烷气体完全燃烧生成CO2和H2O(l),放出热量50kJ,则1mol丁烷气体完全燃烧生成CO2和H2O(l),所放出的热量为:![]() ,丁烷气体燃烧的热化学方程式为:C4H10(g)+
,丁烷气体燃烧的热化学方程式为:C4H10(g)+![]() O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol,故答案为:C4H10(g)+
O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol,故答案为:C4H10(g)+![]() O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol;
O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol;
(4)1molHgO(s)分解为液态汞和氧气,吸热90.7kJ,热化学方程式为:HgO(s)=Hg(l)+![]() O2(g) △H=+90.7kJ/mol,故答案为:HgO(s)=Hg(l)+
O2(g) △H=+90.7kJ/mol,故答案为:HgO(s)=Hg(l)+![]() O2(g) △H=+90.7kJ/mol。
O2(g) △H=+90.7kJ/mol。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如下图所示。
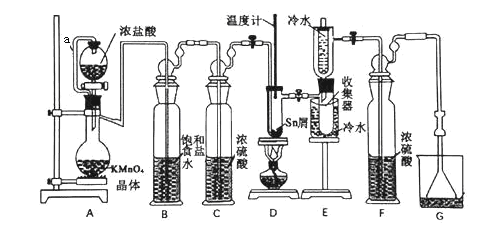
已知:①SnCl2、SnCl4有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4遇水极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是__________,装置A中发生反应的离子方程式为_____________ 。
(2)当观察到装置F液面上方出现______ 现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有两点:加快氯气与锡反应和_________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为_______________________________。
(4)Cl2和Sn的反应产物有SnCl4和SnCl2,为了防止产品中带入过多的SnCl2,装置D可改为油浴加热来控制温度,该温度范围是________。
(5)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3===SnCl4+2FeCl2,再用0.1000 mol·L—1 K2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液 20.00 mL,则SnCl4产品的纯度为_______________。



