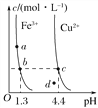
题目内容
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、D同主族,B、C、D、E同周期,B、A可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,C是地壳中含量最高的金属元素。短周期中,B原子半径最大,E的最高价氧化物对应水化物酸性最强。
(1)E的最高价氧化物对应的水化物的分子式为________________;
(2)D与E可形成分子式为D2E2的物质,该物质为浅黄色油状液体,有特殊气味,是一种重要的工业添加剂。则D2E2的结构式为______________;
(3)B、C、D、E、A简单离子半径由大到小的顺序为_______________(用离子符号表示)
(4)用电子式表示化合物甲的形成过程________;
(5)C元素的单质能与B元素的最高价氧化物的水化物发生反应,写出该反应离子方程式_________。
【答案】HClO4 Cl-S-S-Cl S2->Cl->O2->Na+>Al3+ ![]() 2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
A、B、C、D、E都是短周期元素,原子序数依次增大,B、A可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则甲为Na2O、乙为Na2O2,A是O元素,B是Na元素;B、C、D、E同周期,A、D同主族,则D为S元素,C是地壳中含量最高的金属元素,则C为Al元素,E的最高价氧化物对应的水化物是最强的含氧酸,则E是Cl元素。然后进行分析解答。
根据上述分析可知A是O元素,B是Na元素,C为Al元素,D为S元素,E是Cl元素。离子化合物甲和乙分别是Na2O、Na2O2。
(1)E的最高价氧化物对应的水化物是高氯酸,分子式是HClO4;
(2)D与E可形成分子式为D2E2的物质S2Cl2,该物质为浅黄色油状液体,有特殊气味,是一种重要的工业添加剂。在该物质分子中两个S原子形成一个共价键,每个S原子再与Cl原子形成一个共价键,从而使每个原子都达到最外层8个电子的稳定结构,因此D2E2的结构式为Cl-S-S-Cl;
(3) A、B、C、D、E的离子分别是O2-、Na+、Al3+、S2-、Cl-。O2-、Na+、Al3+核外电子排布是2、8,S2-、Cl-核外电子排布是2、8、8,对于电子层结构相同的离子来说,核电荷数越大离子半径越小;对于电子层结构不同的离子来说,离子核外电子层数越多,离子半径越大,因此这些元素的简单离子半径由大到小的顺序为S2->Cl->O2->Na+>Al3+;
(4)化合物甲是Na2O,Na原子失去电子,变为Na+,O原子获得2个电子形成O2-,2个Na+与1个O2-通过离子键结合,用电子式表示化合物甲的形成过程为![]() ;
;
(5)C元素的单质Al能与B元素的最高价氧化物的水化物NaOH溶液发生反应,产生偏铝酸钠和氢气,该反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。

【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
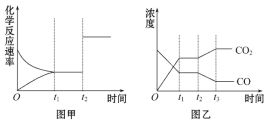
①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。