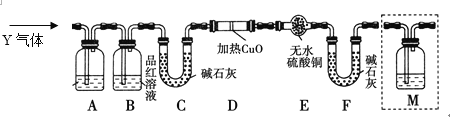
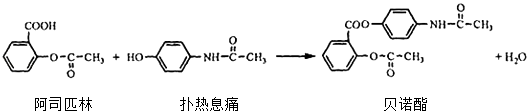
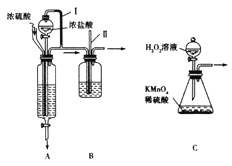
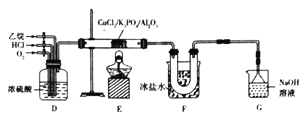
题目内容
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) ![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化如图所示。由图可得出不正确的结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化如图所示。由图可得出不正确的结论是( )

A. 反应△H<0
B. 反应物浓度a 点大于 b 点
C. 反应在c点达到平衡状态
D. SO2 的转化率:a~b 段小于 b~c 段
【答案】CD
【解析】A.反应开始反应物浓度最大,但反应速率随着反应进行再逐渐增大,说明反应为放热反应,所以A选项是正确的;B.反应向正反应进行时,随着反应的进行,反应物浓度逐渐降低,所以B选项是正确的;C.c点反应速率最大,随后正反应速率逐渐减小,反应继续向正反应方向进行,但没有达到平衡状态,故C错误;D.因为 a~b 段的反应速率大于b~c 段反应速率,所以SO2 的转化率:a~b 段大于 b~c 段,D选项是错误的; 所以答案:CD。

练习册系列答案
相关题目
【题目】下列关于物质分类的正确组合是( )
分类组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2SO3 | H2SO4 | NaHCO3 | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | NO |
C | NaOH | CH3COOH | CaF2 | CO2 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO2 |
A.AB.BC.CD.D