��Ŀ����
����Ŀ����������ijЩ����Ԫ���ڹ�ҵ���������ż�����Ҫ�����á�
��1������Cr������Ϊ������ֵ����Ӽ�����
��д��Cr�����ڱ��е�λ��______��
����ԭ�Ӻ�������Ų�������ܲ������______��
����lmolCrO5������ CrΪ+6�ۣ��У����й���������ĿΪ______��
��2������V�����ҹ��ķ��Ԫ�أ�����Ϊ����ҵ��ζ�������㷺���ڴ���������ҵ���ش��������⣺
��д����̬��ԭ�ӵļ۵����Ų�ͼ��______��
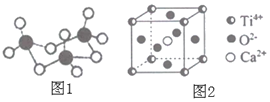
��V2O5������SO2ת��ΪSO3�Ĵ�����SO3�������廷״�ṹ��ͼ1��ʾ���ýṹ��Sԭ�ӵ��ӻ��������Ϊ______��
��3������Ni����һ���������л���Ӧ������Ni����CO�γ����������ε������ Ni��CO��4��������ԭ����______����Ԫ�ط��ţ���
��4���ѣ�Ti������Ϊ��21���ͽ����������ѿ�CaTiO3�������ǹ�ҵ��ȡ�ѵ���Ҫԭ�ϣ��侧���ṹ��ͼ2����������Ϊa=0.266 nm�������� Ti��Ca��O�ֱ��ڶ��ǡ����ġ�����λ�á�
��Ti��O֮�����̾���Ϊ______nm��
����Ti���ڵ�O����Ϊ______��
���𰸡��������ڵ�VIB�� N 2NA ![]() sp3 C 0.188 12
sp3 C 0.188 12
��������
�Ţ�Cr��24��Ԫ�أ�λ�ڵ������ڵ�VIB�壻�ڻ�̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d54s1����ԭ�Ӻ�������Ų�������ܲ��ǵ��ĵ��Ӳ㣻��CrO5��5��O��Ϊ-6�ۣ��ض���4��Ϊ-1�ۣ�CrO5���ӽṹʽΪ![]() ��
��
�Ƣٷ�ԭ�Ӽ۵����Ų�ʽΪ3d34s2���������ԭ�������ع����۵����Ų�ͼ���ڸ÷�����Sԭ�Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Sԭ���ӻ����͡�
��Cԭ����Oԭ�Ӿ�����1�Թ¶Ե��ӣ��縺��ԽǿԽ�����ṩ�¶Ե��ӣ�
�Ȣ�Ti��O֮�����̾���Ϊ������Խ��߳��ȵ�һ�룻����Ti���ڵ�O����=3��8��2��
�Ţ�Cr��24��Ԫ�أ�λ�ڵ������ڵ�VIB�壻�ʴ�Ϊ���������ڵ�VIB�塣
�ڻ�̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d54s1����ԭ�Ӻ�������Ų�������ܲ��ǵ��ĵ��Ӳ㣬�ò����ΪN���ʴ�Ϊ��N��
��CrO5��5��O��Ϊ-6�ۣ��ض���4��Ϊ-1�ۣ�CrO5���ӽṹʽΪ![]() ��������������������1mol CrO5���й���������ĿΪ2NA���ʴ�Ϊ��2NA��
��������������������1mol CrO5���й���������ĿΪ2NA���ʴ�Ϊ��2NA��
�Ƣٷ�ԭ�Ӽ۵����Ų�ʽΪ3d34s2���۵����Ų�ͼΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��SO3�������壨SO3��3�Ļ�״�ṹ��Sԭ���γ�4���������ӻ������ĿΪ4��Sԭ�Ӳ�ȡsp3�ӻ����ʴ�Ϊ��sp3��
��Cԭ����Oԭ�Ӿ�����1�Թ¶Ե��ӣ�O�ĵ縺�Ա�C��ǿ��Oԭ�Ӳ����ṩ�¶Ե��ӣ�Cԭ���ṩ�¶Ե��ӣ���Ni(CO)4����ԭ����C���ʴ�Ϊ��C��
�Ȣ�Ti��O֮�����̾���Ϊ������Խ��߳��ȵ�һ��![]() ���ʴ�Ϊ��0.188��
���ʴ�Ϊ��0.188��
����Ti���ڵ�O����=3��8��2=12;�ʴ�Ϊ��12��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д�����Ŀ�����ⶨijNaOH��Һ�����ʵ���Ũ�ȣ�����0.100 0 mol��L��1��HCl����Һ�ζ������(�ü�����ָʾ��)����ش��������⣺
��1���ζ�ʱ��ʢװ����NaOH��Һ����������Ϊ________��
��2���ζ����յ����ɫ�仯Ϊ____________��
��3������ѧ����ʵ���������������ƽ��ʵ�飬���ݼ�¼���£����ʱ���ı���Һ�����Ϊ__________�����������NaOH��Һ�����ʵ���Ũ��Ϊ______��(������λ��Ч����)
ʵ�� ��� | ����NaOH��Һ�����/mL | 0.100 0 mol��L��1 HCl��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |