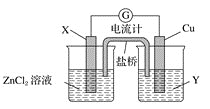
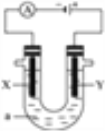
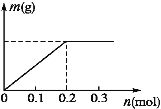
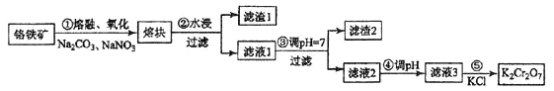
题目内容
【题目】下列方程式书写正确的是
A. HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. H2SO4的电离方程式H2SO4![]() 2H++SO42-
2H++SO42-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
【答案】A
【解析】
强电解质在水溶液中是完全电离,电离方程式用“=”表示,弱电解质则是部分电离,电离方程式用“![]() ”表示,多元弱酸水解分步进行,据此分析作答。
”表示,多元弱酸水解分步进行,据此分析作答。
A. 碳酸氢根离子在溶液中电离出碳酸根离子和氢离子,可表示为:HCO3-+H2O![]() H3O++CO32-,或HCO3-
H3O++CO32-,或HCO3-![]() H++CO32-,故A项正确;
H++CO32-,故A项正确;
B. 硫酸为二元强酸,在水溶液中发生完全电离,其电离方程式为:H2SO4 = 2H++SO42-,故B项错误;
C. 碳酸根离子水解生成碳酸氢根离子和氢氧根离子,其水解过程分两步进行,以第一步为主,水解方程式为:CO32-+H2O![]() HCO3-+OH-,故C项错误;
HCO3-+OH-,故C项错误;
D. 碳酸钙为强电解质,其电离方程式为:CaCO3 = Ca2++CO32-,故D项错误;
答案选A。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目