题目内容
已知下列两个热化学方程式:
H2(g)+
O2(g)═H2O(l)△H=-285kJ?mol-1;C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 220.0kJ?mol-1 实验测得H2和C3H8的混合气体共4mol,完全燃烧生成液态水时放热3075kJ,则混合气体中H2和C3H8的体积比是( )
H2(g)+
| 1 |
| 2 |
| A、1:2 | B、2:1 |
| C、3:1 | D、1:1 |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:计算H2和C3H8的平均燃烧热,根据十字交叉法计算H2和C3H8的体积比即可.
解答:
解:由热化学方程式可知,氢气的燃烧热为285kJ/mol,丙烷的燃烧热为2220.0kJ/mol.H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2790kJ,则混合气体中H2和C3H8的平均燃烧热为
=768.75kJ/mol,根据十字交叉法计算H2和C3H8的体积比:
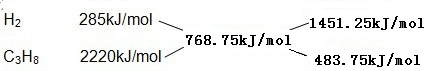
故H2和C3H8的体积比为1451.25kJ/mol:483.75kJ/mol=3:1.
故选C.
| 3075kj |
| 4mol |
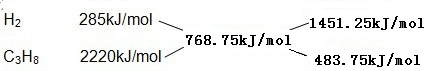
故H2和C3H8的体积比为1451.25kJ/mol:483.75kJ/mol=3:1.
故选C.
点评:本题考查反应热的计算,利用十字交叉法计算,比常规方法简单,容易计算,注意对十字交叉法的理解.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )
| A、只存在于氧气中 |
| B、只存在于SO3中 |
| C、只存在于SO2和SO3中 |
| D、SO2、SO3、O2中都存在 |
下列有关物质的性质或结构的说法正确的是( )
| A、1531P是一种广泛应用于含磷化合物的结构分析和医疗诊断的核素,其原子核内含有15个中子 |
| B、Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4 |
| C、Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱 |
| D、Na的原子半径比Cl的大,但Na+的半径比Cl-的小 |
一定能在下列无色溶液中大量共存的离子组是( )
| A、c(H+)=1×10-13mol?L-1的溶液:Na+、Ba2+、HCO3-、SO42- |
| B、加入铝单质能产生大量氢气的溶液:Na+、NO3-、SO42-、Cl- |
| C、在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| D、在能使紫色的石蕊试液变红的溶液中:Na+、NH4+、SO42-、Cl- |
下列离子方程式书写正确的是:( )
| A、AlCl3溶液与过量的浓氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| C、溴化亚铁溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D、CuSO4溶液与少量的Ba(OH)2溶液:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓ |
酸碱恰好完全中和时( )
| A、酸与碱的物质的量一定相等 |
| B、溶液呈现中性 |
| C、酸与碱的物质的量浓度相等 |
| D、酸所能提供的H+与碱所能提供的OH-的物质的量相等 |
下列叙述仪器“O”刻度位置正确的是( )
| A、在量筒的下端 |
| B、在普通温度计的中间 |
| C、在托盘天平标尺的正中 |
| D、在容量瓶的颈部 |
下列除去杂质的实验方法正确的是( )
| A、除去CO中少量O2:通过灼热的Cu网后收集气体 |
| B、除去K2CO3固体中少量NaHCO3:置于坩埚中加热 |
| C、除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
| D、除去CO2中的少量HCl:通入饱和NaHCO3溶液,收集气体 |