题目内容
【题目】某实验小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,他们进行了如下实验:
①氨的测定:精确称取wgX,加适量水溶解,注入下图所示的蒸馏烧瓶中(夹持和加热仪器略去),然后逐滴加入足量10%NaOH溶液,加热烧瓶将氨蒸出,用V1mLc1mol·L-1的盐酸吸收蒸出的氨,然后取下锥形瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl。.终点时消耗V2 mLNaOH溶液。
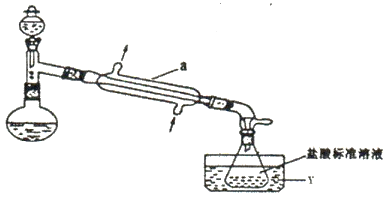
②氯的测定:准确称取样品X配成溶液,用K2CrO4溶液为指示剂,用AgNO3标准溶液滴定,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)
回答下列问题:
(1)X的制备过程中,温度不能过高,其原因是____________________________
(2)仪器a的名称是________________;测定氨前应该对装置进行气密性检验,若气密性不好则测定结果将________(填“偏高”或“偏低”).该滴定过程中选择________做指示剂。
(3)样品中氨的质量分数表达式为_____________________________。
(4)测定氯的过程中,AgNO3标准溶液置于_________(填“无色”或“棕色”)滴定管中;滴定终点时,溶液中已检测不到Cl-[c(Cl-)≤1.0×10-5 mol·L-1],则出现砖红色沉淀时,溶液中c(CrO42-)的最小值为_____________mol·L-1。[已.知:Ksp(AgCl)=1.0×10-10,Ksp( Ag2CrO4)=1.12×10-12]
(5)经测定分析,样品X中钴、氨和氯的物质的量之比为1:6:3,则制备X的化学方程式为________________________________________。
(6)某同学向CoCl2溶液中加入足量(NH4)2C2O4得到CoC2O4沉淀,在空气中煅烧CoC2O4生成钻氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则所得钴氧化物的化学式为________________。
【答案】温度过高过氧化氢分解,氨气逸出 直形冷凝管 偏低 甲基橙 ![]() ×100% 棕色 0.0112 2CoCl2+2NH4Cl+10NH3+H2O2=2[Co(NH3)4]Cl3+2H2O Co3O4
×100% 棕色 0.0112 2CoCl2+2NH4Cl+10NH3+H2O2=2[Co(NH3)4]Cl3+2H2O Co3O4
【解析】
(1)根据题中所给信息,制备X所需的原料有过氧化氢和液氨,温度过高,过氧化氢分解,液氨转化成氨气逸出;
(2)根据仪器a特点,仪器a为直形冷凝管;气密性不好,氨气泄漏,吸收氨气的量减少,测定结果偏低;根据题中信息,蒸出的氨气被盐酸吸收,生成NH4Cl,溶液显酸性,因此用NaOH滴定过剩的HCl,使用的指示剂为甲基橙;
(3)①中与氨气反应的n(HCl)=(V1×10-3L×c1mol·L-1-V2×10-3L×c2mol·L-1)=(V1c1-V2c2)mol,根据氨气与HCl反应:NH3+HCl=NH4Cl,则有n(NH3)=n(HCl)=(V1c1-V2c2)mol,即氨的质量分数为![]() ×100%;
×100%;
(4)AgNO3不稳定,见光分解,为防止硝酸银分解,用棕色滴定管盛放硝酸银溶液;滴定终点时,溶液检测不到Cl-,c(Cl-)≤1.0×10-5mol·L-1,根据氯化银的溶度积常数可以计算出溶液中c(Ag+)≥1.0×10-5mol·L-1,溶液中c(CrO42-)最低的浓度:c(CrO42-)=Ksp(Ag2CrO4)/c2(Ag+)=1.12×10-12/(1.0×10-5)2=0.0112mol·L-1;
(5)X中钴、氨、氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,制备X的反应中,Co的化合价升高,H2O2作氧化剂,因此反应方程式为2CoCl2+2NH4Cl+10NH3+H2O2=2[Co(NH3)4]Cl3+2H2O;
(6)n(CO2)=1.344L/(22.4L·mol-1)=0.06mol,根据化学式CoC2O4以及原子守恒,推出n(Co)=0.06mol/2=0.03mol,则氧化物中n(O)=(2.41g-0.03mol×59g·mol-1)/(16g·mol-1)=0.04mol,n(Co):n(O)=0.03:0.04=3:4,化学式为Co3O4。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案