题目内容
(16分)广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-等。制备流程如下图
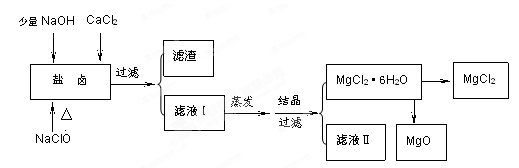
(1)滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。
(2) 加入NaClO的作用是 。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。

请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
;若要得到无水MgCl2须采取的措施是 。

(1)滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。
(2) 加入NaClO的作用是 。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。

请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
;若要得到无水MgCl2须采取的措施是 。
(1)Na+
(2)将Fe2+ 氧化为 Fe3+ ,并形成Fe(OH)3 被除去
(3)① Mg(OH)Cl MgO + HCl↑
MgO + HCl↑
②P(HCl)小,加热时Mg2+ 会发生水解
通入HCl,增大P(HCl,抑制 Mg2+水解
(2)将Fe2+ 氧化为 Fe3+ ,并形成Fe(OH)3 被除去
(3)① Mg(OH)Cl
 MgO + HCl↑
MgO + HCl↑②P(HCl)小,加热时Mg2+ 会发生水解
通入HCl,增大P(HCl,抑制 Mg2+水解
(1)滤渣的成分是Fe(OH)3;滤液Ⅱ中所含的主要杂质离子是Na+。 (2)加入NaClO还能起到的作用是氧化Fe2+使它变成Fe(OH)3沉淀而除去。 (3)直接将MgCl2·6H2O加强热能得到MgO,反应的化学方程式是MgCl2·6H2O
 MgO+2HCl↑+5H2O↑。用MgCl2·6H2O制备无水MgCl2过程中为抑制上述反应,所需要的化学试剂是HCl气体。
MgO+2HCl↑+5H2O↑。用MgCl2·6H2O制备无水MgCl2过程中为抑制上述反应,所需要的化学试剂是HCl气体。① Mg(OH)Cl
 MgO + HCl↑②P(HCl)小,加热时Mg2+ 会发生水解;通入HCl,增大P(HCl,抑制 Mg2+水解。
MgO + HCl↑②P(HCl)小,加热时Mg2+ 会发生水解;通入HCl,增大P(HCl,抑制 Mg2+水解。
练习册系列答案
相关题目
 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
 NH3·H2O+H+
NH3·H2O+H+ 2OH-
2OH-