题目内容
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
| A.a>b | B.a=b | C.a<b | D.无法确定 |
A
解析试题分析:因该反应是放热反应,当在绝热下进行上述反应,则相当于向体系提供能量,升高温度,平衡向吸热方向移动,即此时平衡逆向进行,故反应物的转化率降低。
考点:化学平衡
点评:化学平衡是历年高考重中之重,考生一定要系统备考此知识点。难度较大。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是( )
①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
| A.①③④⑤ | B.①②④⑤ | C.①②③④ | D.①②④ |
密闭容器中,反应xA(g)+yB(g)  zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是 ( )
zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是 ( )
| A.x+y>z | B.平衡向正方向移动 |
| C.B的转化率降低 | D.C的体积分数下降 |
一定温度下,可逆反应H2(g)+I2(g) 2HI(g)达到化学平衡状态的标志是( )
2HI(g)达到化学平衡状态的标志是( )
| A.混合气体的压强不再变化 | B.混合气体的颜色不再变化 |
| C.反应速率v(H2)="0.5v" (HI) | D.c (H2):c(I2):c(HI)=1:1:2 |
在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是 ( )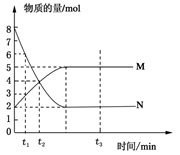
| A.t2时M与N的物质的量浓度之比为1:1 |
| B.t2与t3时刻的混合气体的平均相对分子质量相等 |
| C.反应物与生成物平衡时的物质的量浓度之比是2:5 |
D.0~t2内用M表示的平均反应速率是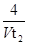 mol/(L?min) mol/(L?min) |
实验室用铜与稀硝酸制取NO时,为加快反应速率可采取的措施是
| A.增加铜的用量 | B.增大压强 |
| C.隔绝空气加热 | D.增大硝酸的浓度 |
(7分)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( ) 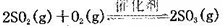 (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表