题目内容
按要求填空.(1)根据常温下氯化铵、氢氧化钡两种晶体混合搅拌反应的现象判断:该反应△S
(2)已知:升高温度时,反应2CH4(g)?C2H4(g)+2H2(g)的平衡转化率增大,现有:C(s)+2H2(g)?CH4(g)△H1;2C(s)+2H2(g)?C2H4(g)△H2则2△H1
(3)在常温常压下测得:C(s)的燃烧热为393kJ/mol,而1mol C(s)燃烧成CO(g)放热110kJ,且6FeO(s)+O2(g)=2Fe3O4(s)△H=-480kJ/mol.请写出CO(g)还原Fe3O4(s)生成FeO(s)的热化学方程式:
(4)已知由气态分子断裂1mol以下共价键吸收的能量为:C-H:410kJ O=O:500kJ C=O:750kJ O-H:460kJ,且常温下1mol水气化时吸收热量45kJ.写出常温下甲烷燃烧的热化学方程式:
分析:(1)根据铵盐与碱反应是吸热反应,根据反应生成气体,判断熵变;
(2)根据温度变化,平衡移动方向判断反应的热效应,根据盖斯定律来比较大小;
(3)先根据题目信息写出热化学方程式,然后依据盖斯定律结合热化学方程式计算得到;
(4)根据反应热△H=反应物总键能-生成物总键能,结合盖斯定律计算.
(2)根据温度变化,平衡移动方向判断反应的热效应,根据盖斯定律来比较大小;
(3)先根据题目信息写出热化学方程式,然后依据盖斯定律结合热化学方程式计算得到;
(4)根据反应热△H=反应物总键能-生成物总键能,结合盖斯定律计算.
解答:解:(1)铵盐与碱反应是吸热反应,△H>0,反应生成氨气,熵值增大,△S>0,故答案为:>;>;
(2)升高温度时,反应2CH4(g)?C2H4(g)+2H2(g)的平衡转化率增大,即反应正向移动,所以正反应为吸热反应,△H>0;已知:C(s)+2H2(g)?CH4(g)△H1 ①2C(s)+2H2(g)?C2H4(g)△H2 ②
根据盖斯定律②-①×2得:2CH4(g)?C2H4(g)+2H2(g)△H=△H2-2△H1>0,所以2△H1<△H2,
故答案为:<;
(3)C(s)的燃烧热为393kJ/mol,则热化学方程式:C(s)+O2(g)═CO2(g)△H=-393kJ/mol①
1mol C(s)燃烧成CO(g)放热110kJ,则热化学方程式:C(s)+
O2(g)═CO(g)△H=-110kJ/mol②
6FeO(s)+O2(g)=2Fe3O4(s)△H=-480kJ/mol③
依据盖斯定律计算②×6-①×6-②×
得到:CO(g)+Fe3O4(s)=3FeO(s)+CO2(g)△H=-43kJ/mol;
故答案为:CO(g)+Fe3O4(s)=3FeO(s)+CO2(g)△H=-43kJ/mol;
(4)CH4(g)+2O2(g)=CO2(g)+2H2O(g)的反应热△H=410 kJ/mol×4+500kJ/mol×2-750kJ/mol×2-460kJkJ/mol×4=-700kJ/mol ①
常温下1mol水气化时吸收热量45kJ,则H2O(L)=H2O(g)△H=+45kJ/mol ②
依据盖斯定律计算①-②×2得到:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-790kJ?mol-1;
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-790kJ?mol-1.
(2)升高温度时,反应2CH4(g)?C2H4(g)+2H2(g)的平衡转化率增大,即反应正向移动,所以正反应为吸热反应,△H>0;已知:C(s)+2H2(g)?CH4(g)△H1 ①2C(s)+2H2(g)?C2H4(g)△H2 ②
根据盖斯定律②-①×2得:2CH4(g)?C2H4(g)+2H2(g)△H=△H2-2△H1>0,所以2△H1<△H2,
故答案为:<;
(3)C(s)的燃烧热为393kJ/mol,则热化学方程式:C(s)+O2(g)═CO2(g)△H=-393kJ/mol①
1mol C(s)燃烧成CO(g)放热110kJ,则热化学方程式:C(s)+
| 1 |
| 2 |
6FeO(s)+O2(g)=2Fe3O4(s)△H=-480kJ/mol③
依据盖斯定律计算②×6-①×6-②×
| 1 |
| 2 |
故答案为:CO(g)+Fe3O4(s)=3FeO(s)+CO2(g)△H=-43kJ/mol;
(4)CH4(g)+2O2(g)=CO2(g)+2H2O(g)的反应热△H=410 kJ/mol×4+500kJ/mol×2-750kJ/mol×2-460kJkJ/mol×4=-700kJ/mol ①
常温下1mol水气化时吸收热量45kJ,则H2O(L)=H2O(g)△H=+45kJ/mol ②
依据盖斯定律计算①-②×2得到:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-790kJ?mol-1;
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-790kJ?mol-1.
点评:本题考查反应热与化学键键能的关系以及盖斯定律的运用,难度中等.

练习册系列答案
相关题目
 请根据所提供的试剂和仪器,按要求填空:
请根据所提供的试剂和仪器,按要求填空:



 +O2
+O2 +2H2O
+2H2O
 为原料合成重要的化工产品
为原料合成重要的化工产品 .合成路线流程图示例如下:
.合成路线流程图示例如下:

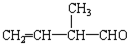 所含官能团的名称是
所含官能团的名称是