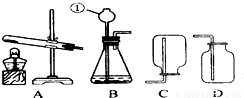
题目内容
 请根据所提供的试剂和仪器,按要求填空:
请根据所提供的试剂和仪器,按要求填空:(1)写出带有标号①的仪器的名称
长颈漏斗
长颈漏斗
(2)若用气体发生装置A来制取O2(使用MnO2作催化剂的情况),其反应的化学方程式为:


(请标出电子转移方向与数目);若用气体发生装置B来制取O23.36L(标准状况),转移电子的数目是
0.6NA
0.6NA
.选择的收集装置是D
D
(填序号).分析:(1)标号①为实验室常用的仪器,熟记常用仪器的名称即可轻松作答;
(2)根据实验室中制取氧气的反应原理结合图中发生装置的特点来进行解答;根据氧化还原反应的原理,在该反应过程中 Cl由+5价降低到-1价,氧元素从-2价上升到0价,据此即可解答;氧气是密度比空气的平均密度大,据此选择收集装置.
(2)根据实验室中制取氧气的反应原理结合图中发生装置的特点来进行解答;根据氧化还原反应的原理,在该反应过程中 Cl由+5价降低到-1价,氧元素从-2价上升到0价,据此即可解答;氧气是密度比空气的平均密度大,据此选择收集装置.
解答:解:(1)图中①是长颈漏斗,长颈漏斗方便加液体药品,
故答案为:长颈漏斗;
(2)若用气体发生装置A来制取O2(使用MnO2作催化剂的情况),所以是氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,反应的化学方程式是2KClO3
2KCl+3O2↑,在该反应过程中 Cl由+5价降低到-1价,降低了6价,2个Cl转移了12个电子,氧元素从-2价上升到0价,升高了2价,6个氧转移了12个电子,1mol氧气转移4mol电子,所以用单线桥表示为: ; 若用气体发生装置B来制取O23.36L(标准状况),标准状况下,气体摩尔体积Vm=22.4L/mol,根据n=
; 若用气体发生装置B来制取O23.36L(标准状况),标准状况下,气体摩尔体积Vm=22.4L/mol,根据n=
=
=0.15mol,氧元素从-2价上升到0价,升高了2价,1mol氧气转移4mol电子,所以0.15molO2转移电子的数目是0.6NA;氧气是密度比空气的平均密度大的气体,需用向上排空气法收集,所以选D装置,
故答案为: ;0.6NA;D.
;0.6NA;D.
故答案为:长颈漏斗;
(2)若用气体发生装置A来制取O2(使用MnO2作催化剂的情况),所以是氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,反应的化学方程式是2KClO3
| ||
| △ |
 ; 若用气体发生装置B来制取O23.36L(标准状况),标准状况下,气体摩尔体积Vm=22.4L/mol,根据n=
; 若用气体发生装置B来制取O23.36L(标准状况),标准状况下,气体摩尔体积Vm=22.4L/mol,根据n=| V |
| Vm |
| 3.36L |
| 22.4L/mol |
故答案为:
 ;0.6NA;D.
;0.6NA;D.点评:本题主要考查了实验室用氯酸钾制取氧气,掌握常见的实验仪器的名称,熟练运用氧化还原的电子转移的表示方法,是解答的关键,题目难度不大.

练习册系列答案
相关题目
(14分)请根据所提供的试剂和仪器,按要求填空:

(1)写出带有标号①的仪器的名称___________
(2)气体发生装置A可用来制取氧气,其反应方程式为___________________________。选择的收集装置是______(选“C”或“D”)。若用E装置收集氧气完毕时,应先 (填序号①或②:①熄灭酒精灯;②从水中取出导气管)
(3)实验室用大理石固体与稀盐酸制备二氧化碳气体,写出反应的化学方程式:_________________________;选用上述装置中的_____________(填序号)作为发生装置;
已知盐酸具有挥发性,二氧化碳气体中含有少量的氯化氢气体,可以用上图中的F装置除去HCl气体(F洗气瓶可吸收HCl气体,不吸收CO2气体,顺利使CO2气体进入下一个装置)。
实验中含有杂质的气体应该从_____________(填“a”或“b”)口进入洗气瓶,洗气瓶中应装_____________(填序号:
| A.NaHCO3溶液, | B.NaOH溶液, | C.澄清石灰水, | D.浓硫酸)写出洗气过程中反应的化学方程式____________________________________。 |