题目内容
两份等体积等浓度的NaOH溶液,分别与体积相等的AlCl3、MgCl2溶液混合,充分反应后Al3+、Mg2+均恰好完全沉淀,则原AlCl3、MgCl2溶液浓度之比是( )
| A、2:3 | B、1:2 | C、1:1 | D、3:2 |
分析:等体积、等浓度的NaOH溶液,则NaOH的物质的量相同,分别与体积相等的AlCl3、MgCl2溶液混合,由AlCl3+3NaOH═Al(OH)3↓+3NaCl、MgCl2+2NaOH═Mg(OH)2↓+2NaCl,可知n(NaCl)=n(NaOH),根据氯离子守恒可知AlCl3、MgCl2溶液中Cl-的物质的量相等,又由于原溶液体积相同,则物质的量浓度之比等于物质的量之比,以此来解答.
解答:解:等体积、等浓度的NaOH溶液,NaOH的物质的量相同,分别与体积相等的AlCl3、MgCl2溶液混合,AlCl3+3NaOH═Al(OH)3↓+3NaCl,溶液中的溶质只有NaCl,n(Na+)=n(Cl-),钠离子全部来自NaOH,则n(Na+)=n(NaCl)=n(Cl-)=n(NaOH),氯离子全部来自AlCl3,
同理MgCl2溶液和NaOH溶液反应:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,溶液中的溶质只有NaCl,n(Na+)=n(Cl-),
钠离子全部来自NaOH,则n(Na+)=n(NaCl)=n(Cl-)=n(NaOH),氯离子全部来自MgCl2,和AlCl3、MgCl2溶液反应的NaOH溶液物质的量相同,
即AlCl3、MgCl2溶液中Cl-的物质的量相等,那么AlCl3、MgCl2物质的量之比为2:3,
又由于原溶液体积相同,则物质的量浓度之比等于物质的量之比,即原AlCl3、MgCl2溶液浓度之比为2:3;
故答案为:A.
同理MgCl2溶液和NaOH溶液反应:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,溶液中的溶质只有NaCl,n(Na+)=n(Cl-),
钠离子全部来自NaOH,则n(Na+)=n(NaCl)=n(Cl-)=n(NaOH),氯离子全部来自MgCl2,和AlCl3、MgCl2溶液反应的NaOH溶液物质的量相同,
即AlCl3、MgCl2溶液中Cl-的物质的量相等,那么AlCl3、MgCl2物质的量之比为2:3,
又由于原溶液体积相同,则物质的量浓度之比等于物质的量之比,即原AlCl3、MgCl2溶液浓度之比为2:3;
故答案为:A.
点评:本题考查物质的量浓度有关计算、化学方程式有关计算,比较基础;若考虑原子守恒来解答,相对更简单.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
某硫酸厂技术科为了防止环境污染并对尾气进行综合利用,采用两种方法吸收尾气中的SO2等气体.
(1)方法一:将尾气通入氨水,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体.为测定生成的(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该混合物样品4份,分别加入等浓度的NaOH溶液50.00mL,使生成的氨气全部逸出,测得有关实验数据如下:
计算所用NaOH溶液的物质的量浓度(写出计算过程).
(2)方法二:用NaOH溶液、石灰及O2吸收尾气SO2,以制取石膏(CaSO4?2H20),此过程的中间产物是NaHSO3.调节尾气排放的流量可获得SO2与NaOH物质的量的最佳比,从而提高亚硫酸氢钠的产量.如图表示n(NaHSO3) 随n(SO2)/n(NaOH)不同值时的变化曲线.请填写下列空白: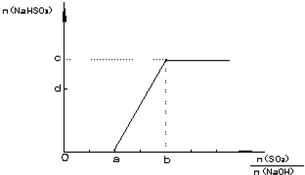
①a= ,b= .(填数值)
②c= ,d= .〔填含有n(SO2)、n(NaOH)的关系式〕
(1)方法一:将尾气通入氨水,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体.为测定生成的(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该混合物样品4份,分别加入等浓度的NaOH溶液50.00mL,使生成的氨气全部逸出,测得有关实验数据如下:
| 实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
| 1 | 7.24 | 50.00 | 1.792 |
| 2 | 14.48 | 50.00 | 3.584 |
| 3 | 21.72 | 50.00 | 4.032 |
| 4 | 36.20 | 50.00 | 2.240 |
(2)方法二:用NaOH溶液、石灰及O2吸收尾气SO2,以制取石膏(CaSO4?2H20),此过程的中间产物是NaHSO3.调节尾气排放的流量可获得SO2与NaOH物质的量的最佳比,从而提高亚硫酸氢钠的产量.如图表示n(NaHSO3) 随n(SO2)/n(NaOH)不同值时的变化曲线.请填写下列空白:

①a=
②c=
为了防止环境污染并对尾气进行综合利用,硫酸厂常用两种方法吸收尾气中的SO2、SO3等气体。
方法一:将尾气通入氨水,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。已知SO2及(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃,欲测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出,测得有关实验数据如下:
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
① | 7.24 | 50.00 | 1.792 |
② | 14.48 | 50.00 | 3.584 |
③ | 21.72 | 50.00 | 4.032 |
④ | 28.96 | 50.00 | 3.136 |
(1)若取3.62 g样品用同样方法实验时,生成氨气的体积(标准状况)为_________L。
(2)该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为_________。
(3)求所用NaOH溶液的物质的量浓度_________。
方法二:用NaOH溶液、石灰及O2吸收尾气,以制取石膏(CaSO4·2H2O),此过程的中间产物是NaHSO3。实际操作中以调节尾气排放的流量来取得SO2与NaOH间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。试写出n(SO2)/n(NaOH)在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)的关系式,填入下表:
n(SO2)/n(NaOH) | n(NaHSO3) |
|
|
|
|
|
|
 当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
。