题目内容
【题目】现有下列十种物质:①Na2O ②Cu(OH)2 ③Zn ④CaCO3 ⑤硫酸溶液 ⑥Ba(OH)2 ⑦干冰 ⑧A12(SO4)3 ⑨HCl水溶液 ⑩KHSO4
(1)其中属于非电解质的有_____________(填序号)。
(2)往②中加入过量的0.1 mol/L⑩的水溶液,发生反应的离子方程式是___________,向所得溶液中继续加入③,会产生无色气泡,该反应的离子方程式是_____________________。
(3)焊接铜器时,可先用NH4Cl除去其表面的氧化铜再进行焊接,该反应可表示为:4CuO+2NH4Cl![]() 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O
①用双线桥标明电子转移的方向和数目。______________________ 。
②该反应中,被氧化的元素是 ,氧化剂是__________________。
③还原剂与氧化产物的物质的量之比为_________________。
④反应中若产生0.2 mol的氮气,则有_______________mol的电子转移。
【答案】 ⑦ Cu(OH)2+2H+= Cu2-+2H2O;Zn+2H+= Zn2++H2↑ 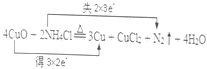 氮(N) CuO 2:1 1.2
氮(N) CuO 2:1 1.2
【解析】(1)①Na2O在熔融状态下能导电,是电解质;②Cu(OH)2在熔融状态下能导电,是电解质;③Zn是单质,既不是电解质,也不是非电解质;④CaCO3在熔融状态下能导电,是电解质;⑤硫酸溶液属于混合物,既不是电解质,也不是非电解质;⑥Ba(OH)2在水溶液里或熔融状态下能导电,是电解质;⑦干冰本身不能电离,属于非电解质;⑧A12(SO4)3在水溶液里或熔融状态下能导电,是电解质;⑨HCl水溶液属于混合物,既不是电解质,也不是非电解质;⑩KHSO4在水溶液里或熔融状态下能导电,是电解质;所以属于非电解质的是⑦;
(2)氢氧化铜与硫酸氢钠溶液反应实质是氢氧化铜与氢离子反应生成铜离子和水,离子方程式:Cu(OH)2+2H+═Cu2++2H2O;硫酸氢钠过量,加入锌,锌与氢离子反应生成氢气,离子方程式:Zn+2H+═Zn2++H2↑;
(3)①在反应过程中,铜化合价降低,失电子,氮元素化合价升高,得电子,所以双线桥法表示为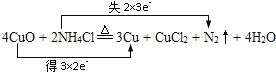 ;
;
②氮元素化合价升高,失去电子,被氧化;氧化铜中Cu元素的化合价降低,作氧化剂;
③还原剂是氯化铵,氧化产物是氮气,由反应可知,二者的物质的量之比为2∶1;
④氮元素化合价由-3降低为0价,生成0.2mol氮气对应失去电子为0.2×2×3=1.2mol。

 名校课堂系列答案
名校课堂系列答案