题目内容
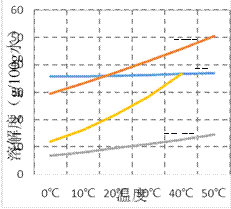
【题目】常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如右图所示,下列有关叙述正确的是( )

A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
【答案】D
【解析】A.①点时没有加入氢氧化钠,溶液中存在HClO和水的电离平衡,故A错误;B.①到②溶液c(H+)之间减小,酸对水的电离的抑制程度减小,则水的电离程度逐渐增大,故B错误;C.②点时溶液存在Cl0-,具有强氧化性,可氧化I-,故C错误;D.②点时溶液pH=7,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(Cl0-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),故D正确;故选D。

【题目】下列说法正确的是( )
A.汽油车在行驶过程中,热能首先转化为化学能,化学能再转化为动能
B.炸药发生爆炸时化学能完全转化为热能
C.炭燃烧时化学能主要转化为光能
D.柴草燃烧时,部分化学能转化为热能
【题目】软锰矿(主要成分为MnO2)可用于制备锰及其化合物,现代冶炼金属锰的工艺流程如下图所示,步骤中杂质离子逐一沉淀。

下表为t℃时,有关物质的Ksp
物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
Ksp | 4.0×10-38 | 2.2 | 5.5 | 1.9 | 6.3 | 9.1 | 2.5 | 2.2 |
软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4===12MnSO4+6CO2↑+18H2O
(1)写出一种能提高还原浸出速率的措施:_________________________
(2)调节pH 步骤中生成的沉淀为________。加入MnF2的主要目的是除去__________ (填“Ca2+”、“Fe3+”或“Cu2+”)
(3)等浓度的(NH4)2S与(N4)2SO4 溶液中,NH4+的浓度大小为:前者________后者(填“>”、“< ” “=” )。
(4)由MnSO4制取MnCO3往MnSO4溶液中加入(NH4)2CO3溶液生成MnCO3,同时还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)![]() Mn(OH)2(s)+CO
Mn(OH)2(s)+CO![]() (aq),t℃时,计算该反应的平衡常数K=_________________(保留一位小数)。
(aq),t℃时,计算该反应的平衡常数K=_________________(保留一位小数)。