题目内容
【题目】把0.6molX气体和0.4mol Y气体混合于2L容器中,发生反应:3X(g)+Y(g)═nZ(g)+2W(g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为 0.03molL﹣1min﹣1 . 计算:
(1)n的值为
(2)前5min内用X表示的反应速率
(3)5min末Y的浓度 .
【答案】
(1)3
(2)0.03mol?(L?min)﹣1
(3)0.15mol/L
【解析】解:(1)Z浓度变化来表示的平均速率为 0.03molL﹣1min﹣1 , 则Z的物质的量变化为:0.03molL﹣1min﹣1×2L×5min=0.3mol,根据物质的量之比等于计量数之比可知,n:2=0.3mol:0.2mol,解得;n=3,所以答案是:3;(2)Z与X的化学计量数都是3,则前5min内用X表示的反应速率与Z表示的反应速率相等,都是0.03mol(Lmin)﹣1 , 所以答案是:0.03mol(Lmin)﹣1;(3)5min内Z的物质的量变化为:0.03molL﹣1min﹣1×2L×5min=0.3mol,根据反应3X(g)+Y(g)═3Z(g)+2W(g)可知5min末总共消耗Y的物质的量为:0.3mol× ![]() =0.1mol,则5min末剩余Y的物质的量为:0.4mol﹣0.1mol=0.3mol,所以5min末Y的物质的量浓度为:
=0.1mol,则5min末剩余Y的物质的量为:0.4mol﹣0.1mol=0.3mol,所以5min末Y的物质的量浓度为: ![]() =0.15molL,所以答案是:0.15mol/L.
=0.15molL,所以答案是:0.15mol/L.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

【题目】回答下列相关问题:
(1)用“>”或“<”填写下表:
电负性 | 第一电离能 | 半径 | 金属性 | 杂化轨道数 |
Al___Mg | S___P | Na+___O2- | Pb___Sn | SO2____SO32- |
(2)某半导体材料由X、Y两种元素组成,已知X的基态原子4p轨道上只有1个电子,Y的基态原子L层上有3个未成对电子,X位于周期表第_____周期____族;该半导体材料的化学式为_____。
(3)在短周期元素中基态原子的p轨道有1个未成对电子的元素可能是____(填元素符号),其中核电荷数最大的元素核外电子排布式是________。
(4)雷式盐(Reinecke’s salt)结构式如下图所示:
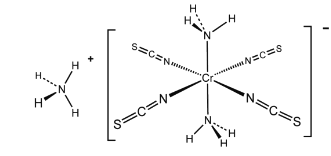
配离子中Cr3+的配体为____(填化学式),Cr3+与配体间形成的共价键又称为____.