题目内容
【题目】铁片镀铜实验中(装置如下图所示),为提高电镀效果,电镀前铁片需依次用NaOH溶液、稀盐酸和水洗涤。下列说法不正确的是
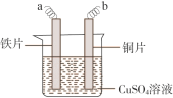
A.稀盐酸的主要作用是除去铁锈
B.a接电源正极,b接电源负极
C.电镀过程中c(Cu2+)基本保持不变
D.阴极发生反应:Cu2++2e– = Cu
【答案】B
【解析】
电镀时,铜片作阳极,即b接电源正极,电极反应为Cu-2e-=Cu2+,铁片作阴极,即a与电源负极相连,电极反应为Cu2++2e-=Cu。
A、电镀前,用NaOH溶液除去铁片上的油渍,用稀盐酸除去铁锈,A正确;
B、电镀时,a接电源负极,b接电源正极,B错误;
C、根据两个电极反应,可以推出电镀过程中c(Cu2+)基本保持不变,C正确;
D、阴极的电极反应为Cu2++2e-=Cu,D正确;
故选B。

练习册系列答案
相关题目
【题目】下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
选项 | 微粒组 | 所加试剂 | 离子方程式 |
A | NH | 少量Ba(OH)2溶液 | 2NH |
B | Mg2+、Cl-、HCO | 过量NaOH溶液 | Mg2++2HCO |
C | Fe2+、NO | NaHSO4溶液 | HSO |
D | K+、CO | 通入少量CO2 | CO |