题目内容
下列实验叙述正确的是( )
| A.新制氯水放置数天,溶液中的Cl2分子数目不变 |
| B.久置的氯水可使蓝色石蕊试纸先变红后褪色 |
| C.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| D.钠投入硫酸铜溶液中有红色粉末产生 |
C
解析试题分析:A新制氯水放置数天后会发生反应:Cl2+H2O="HCl+HClO," HClO光照分解产生氧气和HClO, HClO光照分解产生氧气和HCl,浓度降低。故放置后溶液中的Cl2分子数目减少。错误。B久置的氯水次氯酸浓度降低,氧化性减弱,只能使可使蓝色石蕊试纸变红。错误。C铜丝在氯气里剧烈燃烧,生成棕黄色的烟。正确。D钠投入硫酸铜溶液中时,先与水发生反应生成氢氧化钠和氢气,然后是氢氧化钠与硫酸铜发生复分解反应产生氢氧化铜蓝色沉淀。而并非将铜置换出来。错误。
考点:考查氯气、次氯酸、金属钠等元素、化合物的性质等的知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将5.1g镁铝合金,投入到500mL2.0mol/L的盐酸中,金属完全溶解,再加入4.0mol/L的NaOH溶液,若要生成的沉淀最多,则NaOH溶液的体积是: ( )
| A.200mL | B.250ml | C.425mL | D.560mL |
下列关于钠的化合物的说法正确的组合是
①NaCl可作厨房调味品,也可用于氯碱工业
②Na2O2可用于呼吸面具或潜水艇中的供氧剂
③Na2CO3水溶液显碱性,可用于去除油污
④NaHCO3受热易分解放出CO2,可用来制作糕点
| A.只有①②③ | B.只有①③④ | C.只有②③④ | D.①②③④ |
将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热,充分反应后过滤,弃去滤渣,滤液中金属阳离子情况不可能是
| A.只含Cu2+、Fe2+、Zn2+ | B.只含Zn2+ |
| C.只含Fe2+、Zn2+ | D.只含Cu2+、Fe3+、Zn2+ |
在制作印刷电路板的过程中常利用FeCl3溶液与Cu反应,其反应方程式为:
2FeCl3+Cu 2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
| A.残余固体全部是Cu |
| B.残余固体可能为Fe和Cu的混合物 |
| C.最后得到的溶液可能含有Fe3+ |
| D.残余固体是Fe,溶液中一定不含Cu2+ |
把4.6g钠投放到195.4g水中,所得溶液的质量分数为
| A.2.3% | B.大于2.3% | C.4% | D.大于4% |
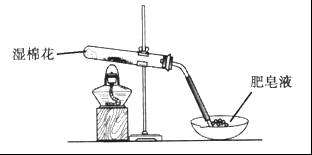
 ,并将溶液分装在两支试管中。
,并将溶液分装在两支试管中。 溶液并放置一段时间,该步反应中的实验现象是_________。
溶液并放置一段时间,该步反应中的实验现象是_________。
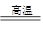 2Cu + SO2
2Cu + SO2 FeSO4 + Cu
FeSO4 + Cu