题目内容
将5.1g镁铝合金,投入到500mL2.0mol/L的盐酸中,金属完全溶解,再加入4.0mol/L的NaOH溶液,若要生成的沉淀最多,则NaOH溶液的体积是: ( )
| A.200mL | B.250ml | C.425mL | D.560mL |
B
解析试题分析:镁铝和盐酸反应,金属完全溶解,所以盐酸过量,全部转化为Mg2+、Al3+和H+。在溶液里和Cl-电荷守恒。在加入氢氧化钠,要是沉淀最多即所有的氯离子全部被OH-取代。故而有500*2.0=4.0V,V=250ml。
考点:化学计算。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
在甲、乙、丙、丁四个烧杯内分别放入0.1mol钠、氧化钠、过氧化钠和氢氧化钠,然后各 加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁的质量分数的大小顺序为( )
| A.甲<乙<丙<丁 | B.丁<甲<乙=丙 |
| C.甲=丁<乙=丙 | D.丁<甲<乙<丙 |
下列现象或反应的原理解释正确的是
| | 现象或反应 | 原理解释 |
| A. | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 |
| B. | 合成氨反应需在高温条件下进行 | 该反应为吸热反应 |
| C. | 镀层破损后,镀锡铁比镀锌铁易腐蚀 | 锡比锌活泼 |
| D. | 2CO=C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S<0 |
有两瓶失去标签的物质的量浓度相同的Na2CO3和NaHCO3稀溶液。下列鉴别方法和所得到的结论不正确的是 ( )
| A.取少量未知溶液两份,分别滴加Ba(NO3)2溶液,有沉淀生成的为Na2CO3溶液 |
| B.取少量未知溶液两份,分别滴加几滴酚酞试液,红色较深的是NaHCO3溶液 |
| C.取少量未知溶液两份,分别滴加稀盐酸溶液,立即有气泡产生的是NaHCO3溶液 |
| D.用pH试纸测定两溶液的pH,pH较小的为Na2CO3溶液 |
现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案
实验设计1:铝镁合金 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验设计2:铝镁合金 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验设计3:铝镁合金 溶液
溶液 过滤,测定得到沉淀的质量
过滤,测定得到沉淀的质量
则能测定出镁的质量分数的是( )
| A.都能 | B.都不能 | C.①不能,其它都能 | D.②③不能,①能 |
1L某混合溶液中,溶质X、Y的浓度都为0.1mol?L﹣1,向混合溶液中滴加某溶液Z(0.1mol?L﹣1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是( )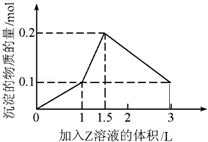
| A.氯化铝、氯化铁、氢氧化钠 | B.氯化铝、氯化镁、氢氧化钠 |
| C.偏铝酸钠、氢氧化钡、硫酸 | D.偏铝酸钠、氯化钡、硫酸 |
向下列溶液中分别加入钠的小颗粒,溶液里无固体析出的是( )
| A.MgCl2溶液 | B.Ca(OH)2饱和溶液 | C.CuSO4溶液 | D.盐酸 |
下面有关碳酸钠和碳酸氢钠说法不正确的是
| A.碳酸氢钠不稳定,受热易分解 |
| B.碳酸氢钠可以用作治疗胃酸过多的药物 |
| C.碳酸钠溶液显碱性,所以碳酸钠是碱 |
| D.碳酸钠既是钠盐、又是碳酸盐、还是可溶性盐 |
下列实验叙述正确的是( )
| A.新制氯水放置数天,溶液中的Cl2分子数目不变 |
| B.久置的氯水可使蓝色石蕊试纸先变红后褪色 |
| C.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| D.钠投入硫酸铜溶液中有红色粉末产生 |