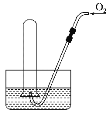
题目内容
【题目】配制![]() 溶液。回答下列问题:
溶液。回答下列问题:
(1)需要固体NaCl________g。
(2)配制操作中,一定用不到的玻璃仪器是________![]() 填选项字母
填选项字母![]() 。还缺少的玻璃仪器是________。
。还缺少的玻璃仪器是________。
A.烧杯 ![]() 胶头滴管
胶头滴管 ![]() 玻璃棒
玻璃棒 ![]() 分液漏斗
分液漏斗
(3)若容量瓶中有少量蒸馏水,所配溶液的浓度将________![]() 填“偏大”、“偏小”或“无影响”,下同
填“偏大”、“偏小”或“无影响”,下同![]() ;若定容时仰视加水至刻度线,所配溶液的浓度将________。
;若定容时仰视加水至刻度线,所配溶液的浓度将________。
【答案】1.2 D 100mL容量瓶 无影响 偏小
【解析】
(1)根据n=cV,再根据n=![]() 计算质量;
计算质量;
(2)配制一定量浓度的溶液需要的仪器有容量瓶、天平(或量筒)、烧杯、玻璃棒、胶头滴管;
(3)根据c=![]() 分析判断。
分析判断。
(1)根据n=cV,该溶液中氯化钠的物质的量=0.2mol/L×0.1L=0.02mol,根据n=![]() ,氯化钠的质量=nM=0.02mol×58.5g/mol=1.17g,由于天平的精确度为0.1g,则需要固体NaCl的质量为1.2g;
,氯化钠的质量=nM=0.02mol×58.5g/mol=1.17g,由于天平的精确度为0.1g,则需要固体NaCl的质量为1.2g;
(2)配制一定量浓度的溶液需要的仪器有容量瓶、天平(或量筒)、烧杯、玻璃棒、胶头滴管,一定用不到的玻璃仪器是分液漏斗,配制100mL0.2 mol/L的氯化钠溶液,还缺少的玻璃仪器是100mL容量瓶;
(3)若容量瓶中有少量蒸馏水,对所配溶液的体积无影响,所配溶液的浓度不变;若定容时仰视加水至刻度线,导致所配溶液的体积偏大,物质的量不变,根据c=![]() ,溶液的浓度将偏小。
,溶液的浓度将偏小。

【题目】废水中氨态氮以NH3H2O、NH3和NH4+的形式存在,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点。
Ⅰ.沉淀法
向废水中投入MgCl2和Na2HPO4,生成MgNH4PO46H2O沉淀,可将氨态氮含量降至10mg·L1以下。
(1)NH3的电子式:______。
(2)废水中的NH3H2O转化为MgNH4PO46H2O的离子方程式是______。

(3)16℃时,向废水中加入MgCl2和Na2HPO4,使镁、氮、磷物质的量之比为1︰1︰1,沉淀过程中的pH对剩余氨态氮浓度的影响如图。欲使剩余氨态氮浓度低于10mg·L1,pH的适宜范围是______,pH偏大或者偏小均不利于MgNH4PO46H2O的生成,原因是______。
Ⅱ.微波—氧化法
(4)仅对废水进行微波加热,pH对氨态氮脱出的影响如下表。
溶液pH | 6~7 | 8~9 | 10~11 | 11~12 |
剩余氨态氮浓度(mg·L1) | 156 | 100 | 40 | 14 |
表中数据表明:pH增大有利于废水中化学平衡______(用化学用语表示)的移动。
(5)微波协同CuO和H2O2除去氨态氮
①其他条件相同,取相同体积的同一废水样品,微波10min,剩余氨态氮浓度与一定浓度H2O2溶液添加量的关系如下图。据图推测CuO在氨态氮脱除中可能起催化作用,理由是______。

②微波协同CuO有利于H2O2除去氨态氮。该条件下,H2O2将NH3氧化为N2的化学方程式是______。