题目内容
室温时0.5L 2.0×10-4mol?L-1 BaCl2溶液中,滴入0.5L 1.0×10-3mol?L-1H2SO4溶液,能否析出沉淀?请计算混合后溶液的pH值.(已知Ksp(BaSO4)=1.1×10-10 mol2?L-2)
【答案】分析:先求出混合后溶液中离子的浓度,再求出溶液的离子积Q,若大于>Ksp(BaSO4),则析出沉淀,反之,则无.
氢离子不参与反应,可根据C=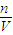 求出.
求出.
解答:解:c(Ba2+)=2.0×10-4/2=1.0×10-4mol?L-1,c(SO42-)=1.0×10-3/2=5.0×10-4mol?L-1.
Q=c(Ba2+)?c(SO42-)=5.0×10-8mol2?L-2>Ksp(BaSO4),所以会析出沉淀.
c(H+)=1.0×10-3×2/2=1.0×10-3,则pH=3.
答:析出沉淀;pH=3.
点评:本题考查沉淀的溶度积常数,难度不大,注意若离子积Q大于>Ksp(BaSO4),则析出沉淀,反之,则无.
氢离子不参与反应,可根据C=
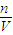 求出.
求出.解答:解:c(Ba2+)=2.0×10-4/2=1.0×10-4mol?L-1,c(SO42-)=1.0×10-3/2=5.0×10-4mol?L-1.
Q=c(Ba2+)?c(SO42-)=5.0×10-8mol2?L-2>Ksp(BaSO4),所以会析出沉淀.
c(H+)=1.0×10-3×2/2=1.0×10-3,则pH=3.
答:析出沉淀;pH=3.
点评:本题考查沉淀的溶度积常数,难度不大,注意若离子积Q大于>Ksp(BaSO4),则析出沉淀,反之,则无.

练习册系列答案
相关题目
 实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题