题目内容
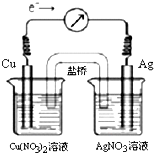 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )分析:A.原电池放电时,盐桥中阳离子向正极移动;
B.当电流计指针为0时,该反应达平衡,但平衡常数K不等于0;
C.若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加,Cl-与溶液中的Ag+形成AgCl沉淀,脱离溶液体系c(Ag+)逐渐减小,根据
和化学平衡常数的比值大小判断反应方向,当
>化学平衡常数时,反应向正反应方向移动,当
=化学平衡常数,反应达到平衡状态,当
<化学平衡常数
时,反应向逆反应方向移动;
D.向硝酸铜溶液中加入氢氧化钠固体时,氢氧化钠和硝酸铜反应生成氢氧化铜沉淀,根据
与化学平衡常数K′比较确定反应方向.
B.当电流计指针为0时,该反应达平衡,但平衡常数K不等于0;
C.若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加,Cl-与溶液中的Ag+形成AgCl沉淀,脱离溶液体系c(Ag+)逐渐减小,根据
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
时,反应向逆反应方向移动;
D.向硝酸铜溶液中加入氢氧化钠固体时,氢氧化钠和硝酸铜反应生成氢氧化铜沉淀,根据
| c(Cu2+) |
| c2(Ag+) |
解答:解:A.该原电池中,铜作负极,银作正极,放电时,硝酸钾中的钾离子向硝酸银溶液移动,故A错误;
B.当电流计指针为0时,该反应达平衡状态,但平衡常数K不等于0,故B错误;
C.向AgNO3aq中加入NaCl固体(固体可以忽略稀释影响),Cl-与溶液中的Ag+形成AgCl沉淀,脱离溶液体系,c(Ag+)逐渐减小,当
逐渐接近K(反应速度减小),指针向右偏转幅度减小,
c(Ag+)继续减小,当
等于K(反应速度为0),指针指向0,
c(Ag+)继续减小,当
<K(反应变为逆方向进行),指针向左偏转,所以随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转,故C正确;
D.向Cu(NO3)2溶液中加入NaOH固体,氢氧化钠和硝酸铜反应生成氢氧化铜沉淀,随着NaOH量的增加,当
接近化学平衡常数K′时,反应速率减小,指针向左偏转幅度减小,当
等于化学平衡常数K′时,指针为0,当
小于化学平衡常数K′时,指针向右偏转,所以随着NaOH量的增加指针电流计指针向左偏转幅度减小→指针指向0→向右偏转,故D错误;
故选C.
B.当电流计指针为0时,该反应达平衡状态,但平衡常数K不等于0,故B错误;
C.向AgNO3aq中加入NaCl固体(固体可以忽略稀释影响),Cl-与溶液中的Ag+形成AgCl沉淀,脱离溶液体系,c(Ag+)逐渐减小,当
| c2(Ag+) |
| c(Cu2+) |
c(Ag+)继续减小,当
| c2(Ag+) |
| c(Cu2+) |
c(Ag+)继续减小,当
| c2(Ag+) |
| c(Cu2+) |
D.向Cu(NO3)2溶液中加入NaOH固体,氢氧化钠和硝酸铜反应生成氢氧化铜沉淀,随着NaOH量的增加,当
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
故选C.
点评:本题考查原电池原理及化学平衡,明确指针的偏转幅度含义是解本题关键,知道K与
的差距越大,反应速度越快,难度中等.
| c2(Ag+) |
| c(Cu2+) |

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
 Cu2+
(aq) + 2Ag (s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是
Cu2+
(aq) + 2Ag (s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是