题目内容
3.在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2变化曲线的是b.用O2表示0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为:
PbO2+Pb+2H2SO4═2PbSO4↓+2H2O,据此判断工作时正极反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O.
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量无污染物质并放出大量热.反应的化学方程式为N2H4+2H2O2=N2+4H2O.

分析 (1)第5s时NO为0.007mol,NO转化率=$\frac{NO物质的量变化量}{NO起始物质的量}$×100%;
(2)NO2是产物,随反应进行浓度增大,由方程式可知平衡时△c(NO2)=△c(NO).
根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(4)原电池正极发生还原反应,PbO2在正极获得电子,硫酸溶液条件下,生成PbSO4与H2O;
(5)液态肼(N2H4)和双氧水混合反应时,产生大量无污染物质,应生成氮气与水.
解答 解:(1)第5s时NO为0.007mol,NO转化率=$\frac{(0.02-0.007)mol}{0.02mol}$×100%=65%,
故答案为:65%;
(2)NO2是产物,随反应进行浓度增大,由方程式可知平衡时△c(NO2)=△c(NO)=$\frac{(0.02-0.007)mol}{2L}$=0.0065mol/L,所以图中表示NO2变化的曲线是b;
2s内用NO表示的平均反应速率v(NO)=$\frac{\frac{(0.02-0.008)mol}{2L}}{2s}$=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,所以v(O2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1,
故答案为:b;1.5×10-3mol•L-1•s-1;
(3)a.若反应达到平衡,则v(NO2)正=2v(O2)逆,由于未指明正、逆速率,不能判断反应是否达到平衡,故a错误;
b.由于反应前后气体体积不等的反应,恒温恒容下随反应进行容器内压强变化,当容器内压强保持不变,说明反应达到平衡,故b正确;
c.由方程式可知v正(NO)=2v正(O2),而v逆(NO)=2v正(O2),则v正(NO)=逆(NO),反应到达平衡,故c正确;
d.混合气体总质量不变,容器容积不变,容器内混合气体密度始终不变,故d错误,
故选:bc;
(4)原电池正极发生还原反应,PbO2在正极获得电子,硫酸溶液条件下,生成PbSO4与H2O,正极电极反应式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,
故答案为:PbO2+4H++SO42-+2e-═PbSO4+2H2O;
(5)液态肼(N2H4)和双氧水混合反应时,产生大量无污染物质,应生成氮气与水,反应方程式为:N2H4+2H2O2=N2+4H2O,
故答案为:N2H4+2H2O2=N2+4H2O.
点评 本题考查化学平衡计算、平衡状态判断、原电池等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

| A. | 硫酸铵固体中n(NH4+)与n(SO42-) | |
| B. | 相同温度下,0.01mol/L的醋酸溶液与0.02mol/L 醋酸溶液中的c(H+) | |
| C. | 液面均在“0”刻度时,50mL酸式滴定管和25mL酸式滴定管内所盛溶液的体积 | |
| D. | 硫酸铵溶液中,c(NH4+)与c(SO42-) |
| 操作 | 现象 | 结论 | |
| A | 向某溶液中加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 原溶液中只一定含SO42- |
| B | 向氯乙烷中加入NaOH溶液,加热后加入稀硫酸酸化,最后再加入AgN03溶液 | 产生白色沉淀 | 氯乙烷中含有氯元素 |
| C | 将CO2和SO2混合气体通入饱和Na2CO3溶液 | 气体体积减少 | 除去了CO2中的SO2 |
| D | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2.0 | B. | 12.3 | C. | 1.7 | D. | 12.0 |
 2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭 用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭 用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )| A. | C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(l)△H=-50kJ•mol-1 | |
| B. | C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-50kJ•mol-1 | |
| C. | C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(l)△H=-2000kJ•mol-1 | |
| D. | C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-2000kJ•mol-1 |
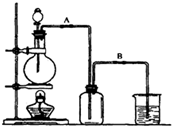 某校化学研究性学习小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图:
某校化学研究性学习小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图: