题目内容
【题目】I.元素周期表的一部分如下表所示,参照元素①~⑩在表中的位置,请回答下列问题:
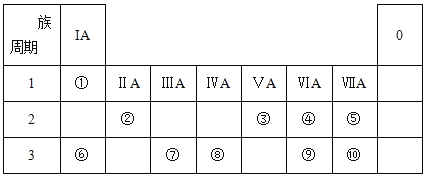
(1)⑨的阴离子结构示意图为____;③的简单氢化物与⑨的最高价氧化物对应的水化物化合生成的正盐的化学式为______。
(2)⑤和⑥形成的化合物的电子式为________。
(3)③、⑧的最高价氧化物对应水化物的酸性由强到弱的顺序为___(用化学式表示,下同)>____。
II.某同学欲利用下图装置验证同周期或同主族元素性质递变规律。
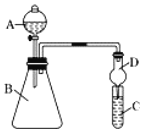
(4)干燥管D的作用是_________。
(5)证明非金属性:Cl>I。在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液变蓝,则C试管中发生反应的离子方程式为________。从环境保护的观点考虑,此装置的缺点是________。
(6)证明非金属性:S>C,在A中加稀硫酸,B中加碳酸钠,C中加澄清石灰水;观察到C中溶液变浑浊的现象,该实验设计的原理是利用_____来比较元素非金属性的强弱。
【答案】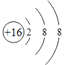 (NH4)2SO4
(NH4)2SO4 ![]() HNO3 H2SiO3 防倒吸 Cl2+2I-=I2+2Cl- 没有尾气处理装置 最高价氧化物对应水化物的酸性强弱
HNO3 H2SiO3 防倒吸 Cl2+2I-=I2+2Cl- 没有尾气处理装置 最高价氧化物对应水化物的酸性强弱
【解析】
I、根据元素周期表可知,①为H,②Be,③为N,④为O,⑤为F,⑥为Na,⑦为Al,⑧为Si,⑨为S,⑩为Cl。结合元素周期律分析解答(1)~(3);
II、(5)A盛放浓盐酸,B盛放高锰酸钾,为氯气的发生装置,C为氯气与淀粉碘化钾混合溶液反应装置,结合氯气的性质分析解答;
(6)稀硫酸与碳酸钠反应生成二氧化碳,C中澄清石灰水变浑浊可以证明有CO2生成,结合元素的非金属性与最高价含氧酸的酸性的关系分析解答。
I、根据元素在周期表中的位置可知,①为H,②Be,③为N,④为O,⑤为F,⑥为Na,⑦为Al,⑧为Si,⑨为S,⑩为Cl。
(1)⑨为S元素,⑨的阴离子即为S2-,核外有18个电子,核内有16个质子,故离子结构示意图为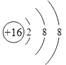 ;③为N元素,③的简单氢化物为NH3,⑨的最高价氧化物的水化物即H2SO4,二者反应成的正盐为硫酸铵,化学式为(NH4)2SO4,故答案为:
;③为N元素,③的简单氢化物为NH3,⑨的最高价氧化物的水化物即H2SO4,二者反应成的正盐为硫酸铵,化学式为(NH4)2SO4,故答案为: ;(NH4)2SO4;
;(NH4)2SO4;
(2)⑤为F元素,⑥为Na元素,⑤和⑥形成的化合物为NaF,是离子化合物,由钠离子和氟离子构成,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)③为N元素,⑧为Si元素,元素的非金属性越强,最高价含氧酸的酸性越强,非金属性N>Si,故③、⑧的最高价氧化物对应水化物的酸性HNO3>H2SiO3,故答案为:HNO3;H2SiO3;
II.(4)球形干燥管D球形部分具有较大空间,能起缓冲作用,能够防止倒吸,可以避免C中液体进入锥形瓶中,故答案为:防倒吸;
(5)KMnO4与浓盐酸反应生成氯气,2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,氯气与淀粉碘化钾混合溶液反应生成碘单质,反应离子方程式为:2I-+Cl2═I2+2Cl-,碘遇淀粉试液变蓝色,故C中溶液变为蓝色;过量的氯气会逸散到空气中,污染环境,可用NaOH溶液吸收,反应离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O,故答案为:2I-+Cl2═I2+2Cl-;缺少尾气处理装置;
(6)在A中加稀硫酸,B中加碳酸钠,两者反应生成硫酸钠、二氧化碳和水,通过C中澄清石灰水变浑浊可以证明有CO2生成,即证明酸性H2SO4强于H2CO3,而最高价含氧酸的酸性越强,则元素的非金属性越强,故可以证明非金属性S>C,即该实验设计的原理是利用最高价含氧酸的酸性强弱比较来比较元素非金属性的强弱,故答案为:最高价含氧酸的酸性强弱。

【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1—溴丁烷的反应如下:
NaBr+H2SO4HBr+NaHSO4 ①
R—OH+HBr![]() R—Br+H2O ②
R—Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备实验中,下列仪器最不可能用到的是________。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.长颈漏斗
(2)溴代烃的水溶性______(填“大于”、“等于”或“小于”)相应的醇,将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在______(填“上层”、“下层”或“不分层”)
(3)制备操作中,加入的浓硫酸必需进行稀释,其目的是____________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于______________ ;
但在制备1—溴丁烷时却不能边反应边蒸出产物,其原因是_______________________。
(6)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2后进行的实验操作是______(填字母)
a.分液 b.蒸馏 c.萃取 d.过滤
(7)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后______(按实验的操作顺序选填下列序号)①加热 ②加入AgNO3 ③加入稀HNO3 ④加入NaOH溶液.