题目内容
【题目】下列说法正确的是( )
A.把100mL 3molL﹣1的H2SO4跟100mL H2O混合,硫酸的物质的量浓度改变为1.5molL﹣1
B.把200mL 3molL﹣1的BaCl2溶液跟100mL 3molL﹣1的KCl溶液混合后,溶液中的C(Cl﹣)仍然是3molL﹣1
C.把100g20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10%
D.把100mL 20%的NaOH溶液跟100mL H2O混合后,NaOH溶液的质量分数是10%
【答案】C
【解析】解:A、稀释前后溶质硫酸的物质的量不变,混合溶液体积小于200ml,所以稀释后硫酸的物质的量浓度大于为1.5molL﹣1 , 故A错误;
B、3molL﹣1的BaCl2溶液中氯离子浓度为6mol/L,3molL﹣1的KCl溶液中氯离子浓度为3molL,氢离子浓度介于3mol/L~6mol/L,若忽略体积变化,混合后氯离子浓度约为 ![]() =5mol/L,故B错误;
=5mol/L,故B错误;
C、混合后溶液质量为200g,溶质氯化钠的质量不变为100g×20%=20g,所以混合后氢氧化钠溶液质量分数为![]() ×100%=10%,故C正确;
×100%=10%,故C正确;
D、水的密度小于氢氧化钠溶液密度,混合后溶液的质量小于2倍的100mL20%的氢氧化钠溶液质量,所以混合后的氢氧化钠溶液的质量分数大于10%,故D错误.
故选:C.

 小学课时特训系列答案
小学课时特训系列答案【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。
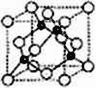
①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热.图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略). 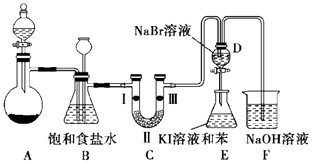
(1)上述反应中是氧化剂,是还原剂,若反应中氧化产物比还原产物多 1mol,则转移的电子数目为 .
(2)装置B的作用是 , 实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象: .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入(选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱. 已知Br2 的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶苯,且 I2 的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明 Cl2的氧化性大于 Br2 , 请写出D中对应的离子方程式并用双线桥法表示出电子转移情况: . 打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象( 填“能”或“不能”)说明Br2的氧化性大于I2 .
(5)装置F的作用是除去污染性的物质(Cl2、Br2 等),已知Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3 , 且 ![]() 值与温度高低有关. 若烧杯中装有500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为L(忽略Cl2溶于水).
值与温度高低有关. 若烧杯中装有500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为L(忽略Cl2溶于水).