��Ŀ����
����Ŀ�����������ַ��������Ƶð�ɫ��Fe(OH)2����:
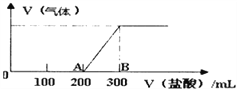
������һ���ò���Fe3+��FeSO4��Һ���ò���O2������ˮ���Ƶ�NaOH��Һ��Ӧ���Ʊ���
ʵ��������������������������FeSO4��Һʱ��һ����������ۺ�ϡ�������������۵�Ŀ����_____________��
��������������ͼ��ʾ��װ��������NaOH��Һ����м��ϡH2SO4���Լ����Ʊ���

��1��ʵ�鿪ʼʱ��ֹˮ��e��______(�������������ر���)�ġ�
��2����μ���װ���ڿ����Ѿ��ž�?________________��
��3���ž�װ���ڿ�����Ϊ���Ƶð�ɫFe(OH)2����������������________��
��4����������f�ŵ�Լ2/3Һ������ʱ�b��B���Լ�ƿ�з����Ļ�ѧ��Ӧ����ʽΪ________��
��5�����и�ͼʾ��________(�����)�ܽϳ�ʱ�俴��Fe(OH)2��ɫ������

���𰸡� Ϊ�˷�ֹFeSO4������ �� �ռ�װ��B���Լ�ƿ�Ϸ����ܿڴ����������鴿����������������װ���ڿ����Ѿ��ž� �ر�ֹˮ��e 4Fe(OH)2+2H2O+O2=4Fe(OH)3 �٢ڢ�
��������������һ��ʵ��������������������������FeSO4��Һʱ���������������ܹ�ˮ�⣬�����ױ�����������Ϊ������ˮ��ͷ�ֹ��������һ����������ۺ�ϡ���ᣬ���м������ۿ��Է�ֹFeSO4���������ʴ�Ϊ��Ϊ�˷�ֹFeSO4��������
����������(1)�����������ױ������е����������������Ҫ�����ɵ������ž�װ���еĿ�������ʵ�鿪ʼʱ��ֹˮ��e����ʴ�Ϊ����
(2)���Bװ�õ�C���ڴ��ų����������ȣ����ų�����������ʱ��˵��װ���п����Ѿ��ž����������Ϊ���ռ�װ��B���Լ�ƿ�Ϸ����ܿڴ����������鴿����������������װ���ڿ����Ѿ��ž����ʴ�Ϊ���ռ�װ��B���Լ�ƿ�Ϸ����ܿڴ����������鴿����������������װ���ڿ����Ѿ��ž���
(3)�ž�װ���ڿ�����Ϊ���Ƶð�ɫFe(OH)2��������Ҫ�ر�ֹˮ��e���������������ɣ���ƿ�������ѹǿ���������ɵ���������ѹ���������������з�Ӧ���������������������ʴ�Ϊ���ر�ֹˮ��e��
(4)��������f�ŵ�Լ2/3Һ�壬�����ܹ����ܽ���Bװ�ã���������������������������������Ӧ�Ļ�ѧ��Ӧ����ʽΪ4Fe(OH)2+2H2O+O2=4Fe(OH)3���ʴ�Ϊ��4Fe(OH)2+2H2O+O2=4Fe(OH)3��
(5)����������Ϣ��֪Ҫ�ϳ�ʱ�䱣��Fe(OH)2��������������ȡ�����о����ܼ��ٺͿ����Ӵ����Ա�3��ʵ�������Կ��Է���������ʢ������������Һ�ĵι�������л�ԭ�����۵�����������Һ�У����Ա����Թ��в������������������������������ܼ����������Ӵ�������Fe��ϡ���������������ų�װ���е�����������Ҳ�ܼ����������Ӵ������м����л����������Ϳ����Ӵ��٣����3��װ�ö��ܳ�ʱ��۲쵽�������������ʴ�Ϊ���٢ڢ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����ĵ��ʼ��仯�������ʶ�������;�㷺�� ���������գ�
��1����ѧ�������о����ô������������ٷɻ�β���е�NO��COת���CO2��N2��2NO+2CO ![]() 2CO2+N2+Q��Q��0�� ij�¶��²�ø÷�Ӧ�ڲ�ͬʱ���COŨ�������
2CO2+N2+Q��Q��0�� ij�¶��²�ø÷�Ӧ�ڲ�ͬʱ���COŨ�������
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c��CO�� | 3.60��10��3 | 3.05��10��3 | 2.85��10��3 | 2.75��10��3 | 2.70��10��3 | 2.70��10��3 |
�÷�Ӧƽ�ⳣ��K�ı���ʽΪ���¶����ߣ�Kֵ��ѡ���������С���������䡱����ǰ2s�ڵ�ƽ����Ӧ����v��N2��=����������Ӧ���ܱ������з������ﵽƽ��ʱ�����NOת���ʵĴ�ʩ֮һ�� ��
��2����ҵ�ϳɰ��ķ�Ӧ�¶�ѡ��500�����ҵ�ԭ���� ��
��3��ʵ�����ڹ̶��ݻ����ܱ������м���1mol������3mol����ģ�ҵ�ϳɰ�����Ӧ��һ���������Ѵﵽƽ��ı�־�� �� a��N2��H2��NH3��Ũ��֮��Ϊ1��3��2
b�������ڵ�ѹǿ���ֲ���
c��N2��H2��NH3��Ũ�Ȳ��ٷ����仯
d����Ӧֹͣ�������淴Ӧ�����ʶ�������
��4����������1mol���ʵ�ϡ�����л���ͨ��1mol NH3����Һ����仯���Բ��ƣ�����Ӧ��������Һ������Ũ���ɴ�С��˳��������ͨ��NH3�Ĺ�������Һ�ĵ���������ѡ��������С�������������䡱����