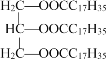题目内容
【题目】某工厂利用下列工艺以废旧铅蓄电池中含铅废料(主要含Pb、PbO、PbO2、PbSO4) 和稀H2SO4为原料制备高纯Pb、PbO等,实现铅的再生利用。其主要流程如下:
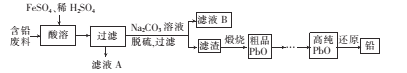
(1)含铅废料需要进行粉碎处理,其原因是____。
(2)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4。若生成1 mol PbSO4,则转移电子的物质的量为__mol。
(3)向滤液B中加入Na2CO3溶液能形成悬浊液,此时溶液中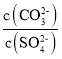 =____。若再向此悬浊液中加入少量Pb(NO3)2固体,则
=____。若再向此悬浊液中加入少量Pb(NO3)2固体,则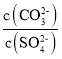 将会 ___(填“增大”“减小”或“不变”)[Ksp(PbSO4)=1.8×10-8;Ksp(PbCO3)=3.6×10-14]
将会 ___(填“增大”“减小”或“不变”)[Ksp(PbSO4)=1.8×10-8;Ksp(PbCO3)=3.6×10-14]
(4)铅易造成环境污染。水溶液中铅的存在形态与水溶液pH的关系如图a所示。pH由7变化到6时,不同形态铅之间转化的离子方程式为_________________
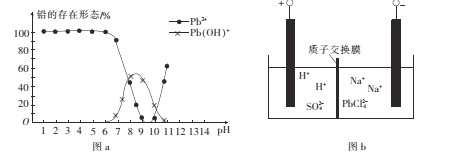
(5)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,进一步电解Na2PbC14溶液生成Pb,如图b所示。
①阴极的电极反应式为 ___。
②电解一段时间后,Na2PbC14的浓度明显下降,为了增大其浓度且实现物质的循环利用,可在阴极区采取的方法是____。
【答案】增大固体反应物的表面积或增大固体反应物的表面积,加快反应速率 1 2.0×10-6 不变 Pb(OH)++H+=Pb2++H2O PbCl42-+2e-=Pb+4Cl- 继续向阴极区增加PbO粗品
【解析】
含铅废料主要含Pb、PbO、PbO2、PbSO4,酸溶中加入FeSO4和稀硫酸,得到PbSO4,加入Na2CO3溶液,脱硫,则发生PbSO4+CO32-![]() PbCO3+SO42-,滤渣为PbCO3,然后煅烧得到PbO,通过热还原法得到Pb,据此分析;
PbCO3+SO42-,滤渣为PbCO3,然后煅烧得到PbO,通过热还原法得到Pb,据此分析;
(1)粉碎的目的是增大固体反应物的表面积或增大固体反应物的表面积,加快反应速率;
(2)酸溶,在Fe2+催化下,发生Pb+PbO2+2H2SO4=2PbSO4+2H2O,生成1molPbSO4时,消耗0.5molPb或PbO2,因此转移电子物质的量为0.5mol×2=1mol;
(3)根据(2)过滤中得到滤渣为PbSO4,加入Na2CO3溶液中发生PbSO4+CO32-![]() PbCO3+SO42-,滤液B中应含有Pb2+、CO32-、SO42-,向滤液B中加入Na2CO3溶液能形成悬浊液,此时溶液中
PbCO3+SO42-,滤液B中应含有Pb2+、CO32-、SO42-,向滤液B中加入Na2CO3溶液能形成悬浊液,此时溶液中![]() =2.0×10-6;向此悬浊液中加入少量Pb(NO3)2固体,温度保持不变,溶度积保持不变,该比值不变;
=2.0×10-6;向此悬浊液中加入少量Pb(NO3)2固体,温度保持不变,溶度积保持不变,该比值不变;
(4)根据图像,溶液显酸性时,Pb元素以Pb2+形式存在,pH由7变化到6时,Pb(OH)+转化为Pb2+,其转化离子方程式为Pb(OH)++H+=Pb2++H2O;
(5)①根据题意,PbCl42-溶液生成Pb,得到电子,发生还原反应,根据电解原理以及图b,阴极反应式为PbCl42-+2e-=Pb+4Cl-;
②根据图b,阳极反应式为2H2O-4e-=O2↑+4H+,H+从左向右移动,PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,在阴极采取的方法是继续向阴极区增加PbO粗品。

 全能练考卷系列答案
全能练考卷系列答案【题目】五氧化二钒(V2O5)在冶金、搪瓷、磁性材料等领域具有重要的应用。实验室以含钒废料(含有V2O3、CuO、MnO、SiO2、有机物)为原料制备V2O5的工艺流程如图所示。

已知:Ⅰ.含钒离子在溶液中的主要存在形式与溶液pH的关系如下表所示。
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要存在形式 | VO2+ | VO3- | V2O74- | VO43- |
Ⅱ.25℃时,部分难溶电解质的溶度积常数如下表所示。
难溶电解质 | Cu(OH)2 | Mn(OH)2 |
溶度积常数(Ksp) | 4.8×10-20 | 4×10-14 |
Ⅲ.25℃时,NH4VO3的溶解度为0.4gL-1;70℃时,NH4VO3的溶解度为63gL-1。
请回答下列问题:
(1)“焙烧”的目的是___。
(2)滤渣1的用途为___(任写一种)。
(3)“调pH”的目的除了使Cu2+沉淀完全外,还有___;调节pH为7时,Cu2+是否沉淀完全?___。(写出计算过程,当溶液中离子浓度小于10-5molL-1时,认为该离子沉淀完全)
(4)“沉锰”时,需将温度控制在70℃左右,温度不能过高或过低的原因为___。
(5)“浓缩结晶”后,需对所得NH4VO3进行洗涤、干燥。洗涤剂宜选用___;证明NH4VO3已洗涤干净的实验操作及现象为___。
(6)“煅烧”时,生成无污染性气体,该反应的化学方程式为___。
【题目】下表是A、B、X、D、E五种有机物的有关信息。
A | A的结构简式为 |
B | ①能使溴的四氯化碳溶液褪色 ②比例模型为 |
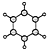
C | ①由C、H两种元素组成 ②球棍模型为 |
D | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 |
E | ①由C、H、O三种元素组成 ②球棍模型为 |
(1)B与溴的四氯化碳溶液反应的生成物的名称是___。
(2)写出在浓硫酸作用下,C与浓硝酸反应的化学方程式___。
(3)A与足量NaOH溶液共热发生皂化反应的化学方程式是___。
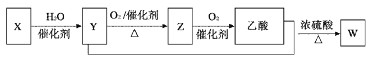
(4)若以B为主要原料合成乙酸,其合成路线如图所示:
![]()
①F物质官能团的名称是___。
②写出反应②的化学方程式___,反应类型为___。
③工业上以B为原料可以合成一种有机高分子,写出反应的化学方程式___。
(5)写出D与E反应的化学方程式___。