��Ŀ����
����Ŀ����ͭ�Ͻ�㷺���ں��չ�ҵ�����и�����л��������Ʊ�ͭ������Ʒ�Ĺ������£�
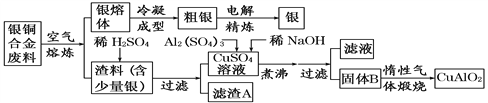
[ע��Al(OH)3��Cu(OH)2 ��ʼ�ֽ���¶ȷֱ�Ϊ450���80��]
��1������A��ϡHNO3��Ӧ�������������ڿ�����Ѹ�ٱ�Ϊ����ɫ���������ɫ�Ļ�ѧ��Ӧ����ʽΪ_________________��
��2����������B�����Ϊ__________��__________��
��3��������չ�����һ����Ӧ�Ļ�ѧ����ʽ��__________________________________����
��4������ͭ�Ͻ���ͭ����������Ϊ64.0%��������5.0kg�����е�ͭ����ȫת��ΪCuAlO2��������Ҫ1.0 mol��L��1��Al2(SO4)3��Һ________L��
��5��CuSO4��ҺҲ�������Ʊ������������������___________��__________�����ˡ�ϴ�Ӻ��
���𰸡� 2NO��O2==2NO2 CuO Al(OH)3 4��2��4��O2 25 ����Ũ�� ��ȴ�ᾧ
��������(1)��ɫ��NO�ڳ�����������е�O2Ѹ�ٻ������ɺ���ɫN02��������ӦΪ2NO+O2=2NO2��
(2)δ���֮ǰ��Cu(OH)2��Al(OH)3��Al(OH)3��Cu(OH)2��ʼ�ֽ���¶ȷֱ�Ϊ450���80�棬��к�Cu(OH)2�ֽ��������ͭ����֪BΪAl(OH)3��CuO��
(3)���չ�����CuO��Al2O3�����·�Ӧ����CuAlO2��O2����ӦǰCuΪ+2�ۣ���Ӧ��Ϊ+1�����ϼ۽���1��Al���ϼ�û�б仯��������Ԫ�صĻ��ϼ����ߣ�������������Ӧǰ��Ϊ-2�ۣ���Ӧ��Ϊ0�����ϼ�����2�����ߵ���С��������2���ٸ���ԭ���غ��4CuO+2Al2O3=4CuAlO2+O2����
(4)�ɹ�ϵʽ��Cu��CuAlO2��n(CuAlO2)= ![]() =50.0mol����CuAlO2Ϊ50.0mol��
=50.0mol����CuAlO2Ϊ50.0mol��
�ɹ�ϵʽ��Al2(SO4)3��2CuAlO2��Al2(SO4)3=n(CuAlO2)��![]() =25.0mol��������Ҫ���Ϊ
=25.0mol��������Ҫ���Ϊ![]() =25.0L��
=25.0L��
(5)��CuSO4��Һ���CuSO45H2O���壬��Ҫ��������Ũ������ȴ�ᾧ(��ᾧ)�����˵Ȳ�����

 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�

