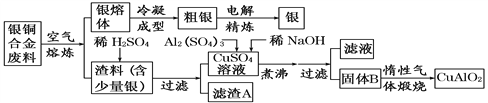
题目内容
【题目】—定温度下,将2 mol SO2和1mol O2充入10 L恒容密闭容器中,发生反应2SO2(g) +O2(g)![]() 2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
A. 0~5 min内,用O2表示的平均反应速率V(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 mol SO2和2 mol O2,平衡时放出的热量小于333.2 kJ
【答案】D
【解析】A、根据反应2SO2(g) +O2(g)![]() 2SO3(g)△H =-196 kJ mol-1可知,当反应放热166. 6 kJ时,有1.7mol二氧化硫和0.85mol氧气参加反应,生成1.7mol三氧化硫,则0~5 min内,用O2表示的平均反应速率V(O2)=0.85mol/(10L×5min)=0.017 mol·L-1·min-1,A正确;B、
2SO3(g)△H =-196 kJ mol-1可知,当反应放热166. 6 kJ时,有1.7mol二氧化硫和0.85mol氧气参加反应,生成1.7mol三氧化硫,则0~5 min内,用O2表示的平均反应速率V(O2)=0.85mol/(10L×5min)=0.017 mol·L-1·min-1,A正确;B、![]() 的值不变时,说明氧气和二氧化硫的浓度保持不变,该反应达到平衡状态,B正确;C、若增大O2的浓度,平衡正向移动,SO2的转化率增大,C正确;D、条件不变,起始向容器中充入4 mol SO2和2 mol O2,相当于加压,平衡时放热大于333.2 kJ,D错误。答案选D。
的值不变时,说明氧气和二氧化硫的浓度保持不变,该反应达到平衡状态,B正确;C、若增大O2的浓度,平衡正向移动,SO2的转化率增大,C正确;D、条件不变,起始向容器中充入4 mol SO2和2 mol O2,相当于加压,平衡时放热大于333.2 kJ,D错误。答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)![]() N2O4(g) △H<0]:
N2O4(g) △H<0]:
容器 | 物质 | 起始浓度/(mol | 平衡浓度/(mol |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.0142 |
NO2 | 0.100 | 0.0716 |
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率a(N2O4)>a(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(I)=![]()
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深