题目内容
15.已知-CN是直线型结构,下列有机分子中,所有的原子不可能处在同一个平面内的是( )| A. | CH2=CH-CN | B. | CH2=CH-CH=CH2 | C. | CH2=C(CH3)-CH=CH2 | D. | CH3CH3 |
分析 根据苯环为平面结构、乙烯为平面结构以及乙炔为直线结构来分析各物质的共面原子.
解答 解:A.乙烯是平面结构,-CN是直线型结构,所有原子在同一平面上,故A错误;
B.乙烯是平面结构,所有原子在同一平面上,故B错误;
C.CH2=C(CH3)-CH=CH2中含有甲基,甲基具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故C正确;
D.CH3CH3中含有甲基,甲基具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故D正确.
故选CD.
点评 本题主要考查常见有机化合物的结构,难度较大,分析时可根据已学过的甲烷、乙烯、苯的结构来类比判断.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
5.下列离子方程式书写正确的是( )
| A. | 氯水和碘化钾反应:Cl2+I-═Cl-+I2 | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
6.某有机物的相对分子质量为74,红外光普图如下,其结构可确定为( )


| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2OCH2CH2CH3 | ||
| C. | (CH3)2CH2OCH2(CH3)2 | D. | CH3CH2OCH2CH3 |
3.在下列叙述中,不正确的是( )
| A. | 40K和40Ca原子中的质子数和中子数都不相等 | |
| B. | H2和D2互为同位素 | |
| C. | 互为同位素的原子,它们的原子核内的中子数一定不相等 | |
| D. | 互为同位素的原子,它们原子核内的质子数一定相等 |
5.某无色透明的溶液能够与铝作用生成氢气,则在此溶液中一定能大量共存的离子组是( )
| A. | HCO3-、NO3-、Ba2+、Cl- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | K+、NH4+、Cl-、OH- | D. | Na+、K+、SO42-、I- |
12.120℃时,0.1mol两种气态烃组成的混合气体完全燃烧后得到8.8gCO2和3.6g水,则这两种烃可能是下列的( )
| A. | CH4和C3H4 | B. | C2H2和C2H6 | C. | CH4和C3H6 | D. | CH4和C2H6 |
9.Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如表所示.其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出X的原子结构示意图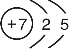 .
.
(2)W与Z的氢化物中,较稳定的是HCl(用化学式表示)
(3)含Y的某种盐常用作净水剂,其净水原理是Al3+3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示)
Ⅱ.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si+6OH--4e-=SiO32-+3H2O;
(5)已知:①C(s)+O2(g)=CO2(g)△H1;
②CO2(g)+C(s)=2CO(g)△H2;
③Si(s)+O2(g)=SiO2(s)△H3.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=△H1+△H2-△H3;
(6)25℃时,往a mol•L-1NH3的水溶液中滴加0.1mol•L-1H2SO4溶液,滴加过程中溶液的导电能力增强(填“增强”、“减弱”或“不变”);实验测得a mol•L-1NH3的水溶液的pH值为12,求此氨水的电离平衡常数Kb=$\frac{1{0}^{-4}}{(a=1{0}^{-2})}$mol•L-1(用含a的代数式表示).
| X | ||||
| Y | Z | W |
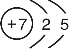 .
.(2)W与Z的氢化物中,较稳定的是HCl(用化学式表示)
(3)含Y的某种盐常用作净水剂,其净水原理是Al3+3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示)
Ⅱ.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si+6OH--4e-=SiO32-+3H2O;
(5)已知:①C(s)+O2(g)=CO2(g)△H1;
②CO2(g)+C(s)=2CO(g)△H2;
③Si(s)+O2(g)=SiO2(s)△H3.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=△H1+△H2-△H3;
(6)25℃时,往a mol•L-1NH3的水溶液中滴加0.1mol•L-1H2SO4溶液,滴加过程中溶液的导电能力增强(填“增强”、“减弱”或“不变”);实验测得a mol•L-1NH3的水溶液的pH值为12,求此氨水的电离平衡常数Kb=$\frac{1{0}^{-4}}{(a=1{0}^{-2})}$mol•L-1(用含a的代数式表示).
10.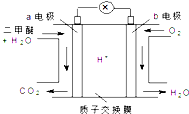 二甲醚(CH3OCH3)是一种绿色、可再生的新能源.下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
二甲醚(CH3OCH3)是一种绿色、可再生的新能源.下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
 二甲醚(CH3OCH3)是一种绿色、可再生的新能源.下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
二甲醚(CH3OCH3)是一种绿色、可再生的新能源.下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上得电子,被氧化 | |
| C. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ | |
| D. | 电池工作时,燃料电池内部H+从a电极移向b电极 |