题目内容
25 ℃ 时,下列各溶液中关系的叙述中,正确的是( )
| A.0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-) =" 0.1" mol/L,则BA(盐)溶液pH<7 |
| B.pH=2的盐酸与pH=l的硫酸溶液中c(H+)之比为2∶1 |
| C.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c(Na+) + c(H+)=c(OH-) + c(CH3COO-) |
| D.4种pH相同的溶液①CH3COONa ②NaClO ③NaHCO3 ④NaOH中c(Na+)的大小顺序是①>②>③>④ |
C
试题分析:根据电荷守恒可判断,选项C是正确的。pH=2的盐酸与pH=l的硫酸溶液中c(H+)分别为0.01mol/L和0.1mol/L,所以其浓度之比是1∶10,B不正确。0.1 mol/L HA(某酸)溶液pH≠1,说明酸是弱酸。0.1 mol/L BOH(某碱)溶液中c(OH-) =" 0.1" mol/L,说明该碱是强碱,所以BA(盐)水解显碱性。溶液pH大于7,A不正确。酸越弱,相应的盐越容易水解,碱性就越强。酸性是醋酸>碳酸>苯酚,所以pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH中,物质的量的浓度大小顺序为①>③>②>④,因此钠离子浓度大小顺序就是①>③>②>④,D不正确。因此答案选C。
点评:本题综合性强,难度较大,主要考查学生的分析能力和解题能力。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
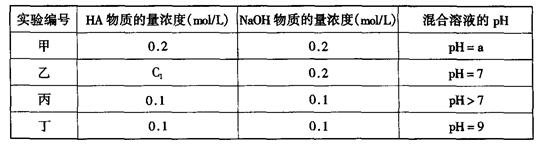 请回答:
请回答: H++HA-,HA-
H++HA-,HA-