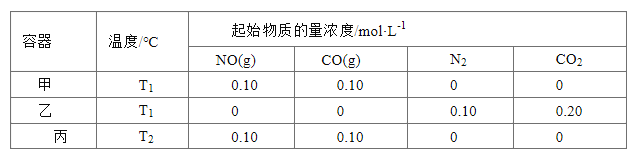
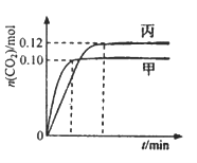
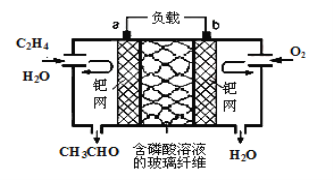
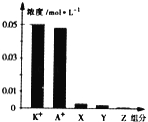
题目内容
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是 ( )
A.该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B.此时正、逆反应速率的大小:v正<v逆
C.若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1
D.0~10min内平均反应速率v(CH3OH)=1.6 mol·(L·min)-1
【答案】C
【解析】
试题分析:A.根据方程式可知该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c2(CH3OH),A错误;B.此时浓度熵Q=![]() <400,因此反应向正反应方向进行,则正、逆反应速率的大小:v正>v逆,B错误;C. 2CH3OH(g)
<400,因此反应向正反应方向进行,则正、逆反应速率的大小:v正>v逆,B错误;C. 2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
起始浓度(mol/L) 0.44 0.6 0.6
转化浓度(mol/L) 2x x x
平衡浓度(mol/L) 0.44-2x 0.6+x 0.6+x
则![]() ,解得x=0.2,所以若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1,C正确;D.根据C中分析可知0~10min内平均反应速率v(CH3OH)=0.4mol/L÷10min=0.04 mol·(L·min)-1,D错误,答案选C。
,解得x=0.2,所以若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1,C正确;D.根据C中分析可知0~10min内平均反应速率v(CH3OH)=0.4mol/L÷10min=0.04 mol·(L·min)-1,D错误,答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】苯甲酸乙酯可用作食用香料。某小组用如下装置制备苯甲酸乙酯
反应原理: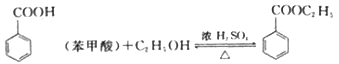 (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O
产物和部分反应物相关数据如下:
物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
熔点/℃ | 122.1 | -117.3 | -34.6 |
沸点/℃ | 249 | 78.3 | 213 |
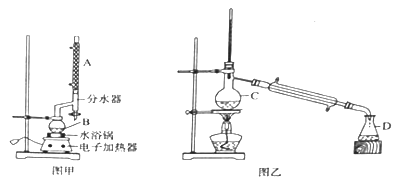
实验步骤:
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品。
回答下列问题:
(1)仪器C的名称______________。
(2)步骤① 若加热后才发现未加沸石,应采取的措施是________;步骤② 采取水浴加热的优点是______。
(3)步骤③ 为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是____________。
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有__________,使用该仪器之前需要进行的操作是__________;无水MgSO4的作用是___________。
(5)步骤⑤收集馏分应控制的最佳温度为____________。
(6)为了提高苯甲酸乙酯的产率,可以采取的措施_________(任填一种)。