题目内容
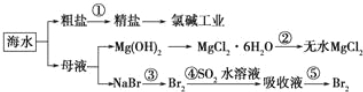
【题目】CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下:

请回答下列问题:
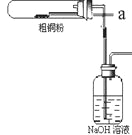
(1)如图装置进行反应①,导管a通入氯气(夹持仪器和加热装置省略)。观察到的现象是______________,
写出铜与氯气反应的化学方程式 ______________________。
(2)上述流程中固体K溶于稀盐酸的目的是___________________。试剂X、固体J的物质分别为____________________。
a.NaOH Fe(OH)3 b.NH3·H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式____________________。
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该红褐色沉淀的主要化学式是_____________。该腐蚀过程的正极反应式为___________________。
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式________。
【答案】试管内有棕色烟产生 Cu+Cl2![]() CuCl2 避免Cu2+水解 c
CuCl2 避免Cu2+水解 c
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42+4H+
Fe(OH)3 ClO+2e+H2O=Cl+2OHCu2++e-+Cl=CuCl
【解析】
(1)铜在氯气中燃烧生成固体氯化铜,观察到棕黄色的烟,反应为:Cu+Cl2![]() CuCl2;
CuCl2;
(2)氯化铜、氯化铁中的金属离子易水解,直接用水溶液配制溶液会产生浑浊,所以加入过量的盐酸来溶解氯化铜、氯化铁,以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,且不能引入新杂质;
(3)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-;
2CuCl↓+4H++SO42-;
(4)氢氧化钠溶液吸收氯气,生成有次氯酸钠,生铁在次氯酸钠和氢氧化钠的混合溶液中发生电化学腐蚀,碳等杂质为正极,铁为负极.负极的电极反应式为Fe-2e-=Fe2+,Fe2++2OH-=Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3,正极的电极反应式为ClO-+2e-+H2O=Cl-+2OH-,红褐色沉淀为氢氧化铁;
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,阴极上是得到电子发生还原反应,Cu2+得到电子生成CuCl,电极反应为:Cu2++e-+Cl-=CuCl。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】下列物质中既能跟氢氧化钠溶液反应,又能跟稀HCl反应的是( ) ①Al2O3 ②Al(OH)3 ③(NH4)2CO3 ④NaHCO3 ⑤BaCl2 .
A.③④⑤
B.②③④⑤
C.①②③④
D.全部
【题目】某学生用中和滴定法测定某烧碱样品的纯度。先准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液。用0.200mol/L的盐酸标准液滴定待测液,滴定时用酚酞做指示剂。试根据实验回答下列问题:
(1)下列有关滴定操作的顺序正确的是
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.③⑤②①④ D.②①③⑤④
(2)用标准的盐酸滴定待测的NaOH溶液时,一手握酸式滴定管的活塞,一手摇动锥形瓶,眼睛注视_________,本实验滴定达到终点的标志是_________________________。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是 ,烧碱样品的纯度是___________
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前刻度(mL) | 滴定后刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
第三次 | 10.00 | 0.20 | 24.20 |
(4)若该实验修改成“用待测碱液滴定盐酸标准液”,则下列操作会使烧碱样品纯度偏高的是
A.锥形瓶用蒸馏水洗净后,先用盐酸标准液润洗再装标准液。
B.碱式滴定管用蒸馏水洗净后未润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前仰视碱式滴定管读数,滴定后俯视滴定管读数