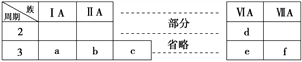
��Ŀ����
����Ŀ���±���Ԫ�����ڱ������ڵ�һ����

(1)�١���Ԫ���н�������ǿ��Ԫ����___________����Ԫ�ط��ű�ʾ����
(2)������γɵĻ�����ĵ���ʽΪ____________��
(3)����Ԫ�آڡ��ۡ�����ۺ������������ǿ������˳����______���ѧʽ����
(4)����Ԫ�آڵĵ�����۵���ۺ������Ũ��Һ��Ӧ�Ļ�ѧ����ʽΪ___________________��
(5)��116��Ԫ�أ�Ԫ�ط���Lv�����й���ѧ����������ίԱ������Ϊ������Ԫ����Ԫ�����ڱ��е�λ����_____________������______Ԫ�أ���������ǽ�������������Ԫ�ش�������������Ӧ��ˮ������仯ѧʽΪ_______��
(6)����������ΪN��R![]() ��������ΪA����ng������ͬ��̬�������������ĵ��ӵ����ʵ���ԼΪ________mol��
��������ΪA����ng������ͬ��̬�������������ĵ��ӵ����ʵ���ԼΪ________mol��
���𰸡� Mg ![]() HNO3>H2CO3 >H2SiO3 C+4HNO3(Ũ)
HNO3>H2CO3 >H2SiO3 C+4HNO3(Ũ) ![]() CO2��+4NO2��+2H2O �������ڵ�VIA�� ���� H2LvO4
CO2��+4NO2��+2H2O �������ڵ�VIA�� ���� H2LvO4 ![]()
������������Ԫ�������ڱ��е�λ�ÿ�֪����ΪHԪ�أ���ΪCԪ�أ���ΪNԪ�أ���ΪFԪ�أ���ΪMgԪ�أ���ΪAlԪ�أ���ΪSiԪ�أ���ΪSԪ�ء�
(1) ͬ����Ԫ�ش��ϵ��£�Ԫ�صĽ���������ǿ��ͬ����Ԫ�ش����ң��������������١���Ԫ���н�������ǿ��Ԫ����Mg���ʴ�Ϊ��Mg��
(2)������γɵĻ�����Ϊ����þ���������ӻ��������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(3)Ԫ�صķǽ�����Խǿ����ۺ����������Խǿ��Ԫ�آ�����������ۺ������������ǿ������˳����HNO3>H2CO3 >H2SiO3���ʴ�Ϊ��HNO3>H2CO3 >H2SiO3��
(4)Ũ������̼�ڼ���ʱ��Ӧ���ɶ���������������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪC+4HNO3(Ũ) ![]() CO2��+4NO2��+2H2O���ʴ�Ϊ��C+4HNO3(Ũ)
CO2��+4NO2��+2H2O���ʴ�Ϊ��C+4HNO3(Ũ) ![]() CO2��+4NO2��+2H2O��
CO2��+4NO2��+2H2O��
(5) 116��Ԫ�������ڱ��е�λ��116-2-8-8-18-18-32-32=-2��8+(-2)=6����Ϊ�������ڣ��ڢ�A�壬�������ڣ��ڢ�A��Ϊ���߸����Ľ���Ԫ������˵������ڣ��ڢ�A��Ԫ�����ڽ���Ԫ��������Ԫ�ش�������������Ӧ��ˮ������仯ѧʽΪH2LvO4���ʴ�Ϊ���������ڵ�VIA����������H2LvO4��
(6)����������ΪN��R![]() ��������ΪA�������������ΪA-N��������ͬ��̬������Ļ�ѧʽΪRO��ngRO�����ʵ���Ϊ
��������ΪA�������������ΪA-N��������ͬ��̬������Ļ�ѧʽΪRO��ngRO�����ʵ���Ϊ![]() =
=![]() mol�������ĵ��ӵ����ʵ���Ϊ
mol�������ĵ��ӵ����ʵ���Ϊ![]() mol��(A-N+8)=
mol��(A-N+8)= ![]() mol���ʴ�Ϊ��
mol���ʴ�Ϊ�� ![]() ��
��

����Ŀ��ij�¶��£�E(g)+F(g)![]() R(g)+N(g)��ƽ�ⳣ��K=4/9�����¶�����A��B��C���������ܱ������У�Ͷ��E(g)��F(g)������ʼŨ�����±��������ж���ȷ����( )
R(g)+N(g)��ƽ�ⳣ��K=4/9�����¶�����A��B��C���������ܱ������У�Ͷ��E(g)��F(g)������ʼŨ�����±��������ж���ȷ����( )
��ʼŨ�� | A | B | C |
c (E)/ molL-1 | 0.010 | 0.020 | 0.020 |
c (F)/ molL-1 | 0.010 | 0.010 | 0.020 |
A. ƽ��ʱ��B��E��ת����Ϊ����40%
B. ƽ��ʱ��A�к�C��F��ת���ʾ�Ϊ40%
C. ƽ��ʱ��C��c(R)��A�е�2����Ϊ0.012molL-1
D. ��Ӧ��ʼʱA��C�з�Ӧ�������