题目内容
【题目】Ⅰ、如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
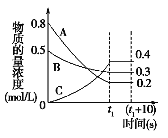
(1)该反应的化学方程式为___________________。
(2)0~t1s 内B气体的平均反应速率为_________。
(3)(t1+10)s 时,A的转化率为___________。
(4)关于该反应的说法正确的是___________。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积大小的锌片、同浓度盐酸做了下列平行实验:
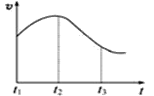
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ______________________,t2~t3速率变化的主要原因是 ______________________。
(2)实验②放出氢气的量减少的原因是 ______________________________。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?_________(填“正确”或“不正确”)。请选择下列相应的a或b作答。_________
a、若不正确,请说明原因: 。
b、若正确则写出实验③中原电池的正极电极反应式 。
【答案】 3A+B![]() 2C
2C ![]() mol·L-1·s-1 75% bc 反应放热,溶液温度升高,反应速率加快 随反应进行,盐酸的浓度减小,反应速度减慢 Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少 正确 2H+ + 2e-=H2↑
mol·L-1·s-1 75% bc 反应放热,溶液温度升高,反应速率加快 随反应进行,盐酸的浓度减小,反应速度减慢 Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少 正确 2H+ + 2e-=H2↑
【解析】Ⅰ、(1)由图象可知A、B的浓度降低,A、B为反应物,A的浓度变化量为0.8mol/L-0.2mol/L=0.6mol/L,B的浓度变化量为0.5mol/L-0.3mol/L=0.2mol/L,C的浓度增大为生成物,C的浓度变化量为0.4mol/L,浓度变化量之比等于化学计量数之比,故A、B、C的化学计量数之比为0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,故反应方程式为:3A+B2C;故答案为:3A+B2C;
(2)0~t1s 内B气体的平均反应速率V=![]() =
=![]() =
=![]() mol/(Ls),故答案为:
mol/(Ls),故答案为: ![]() mol/(Ls);
mol/(Ls);
(3)(t1+10)s 时,平衡没有发生移动,所以A的转化率为![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
(4)a.到达t1时刻该反应达平衡但没有停止,故错误;b.在t1时刻之前,反应向正反应方向移动,所以B气体的消耗速率大于它的生成速率,故正确;c.在t1时刻达平衡,正逆反应速率相等,所以C气体的正反应速率等于逆反应速率,故正确;故选:bc;
II、(1)开始温度起主要作用,纯锌与稀盐酸反应,放出热量,温度升高,t1~t2速率加快;后期c(H+)起主导作用,随着反应进行c(H+)降低,t2~t3反应速率减慢,故答案为:反应放热,溶液温度升高,反应速率加快;随反应进行,盐酸的浓度减小较大,反应速度减慢;
(2)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少,生成氢气量减少,故答案为:Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少;
(3)实验③中锌与铜离子发生置换反应生成金属铜,生成的铜与锌形成了原电池,锌为负极,铜为正极,负极电极反应式为:Zn-2e-=Zn2+,H+在正极发生还原反应,电极反应式为:2H++2e-=H2↑,故答案为:正确;2H++2e-=H2↑。




