题目内容
13.核素146C可用于推算出生物死亡的年代.关于146C有关叙述不正确的是( )| A. | 是一种核素 | B. | 原子核内有8个中子 | ||
| C. | 与126C互为同位素 | D. | 比136C少一个电子 |
分析 A.具有一定数目质子和一定数目中子的一种原子叫做核素;
B.中子数=质量数-质子数;
C.质子数相同,中子数不同的原子互为同位素;
D.核外电子数=质子数.
解答 解:A.146C是质子数为6,中子数为6的一种核素,故A正确;
B.146C是质子数为6,质量为14,中子数为8,故B正确;
C.146C与126C的质子数均为6,中子数分别为8、6,互为同位素,故C正确;
D.146C与126C的质子数均为6,核外电子数都为6,故D错误;
故选D.
点评 本题考查原子的构成及原子中的数量关系,明确质量数、质子数、中子数的关系及同位素即可解答,较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
(1)在0~40s时段,化学反应速率v(NO2)为0.0025mol•L-1•s-1;
此温度下的化学平衡常数K为0.36.
(2)下列能说明该反应达到平衡状态的是BD
A.2v(N2O4)=v(NO2)
B.体系的颜色不再改变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热反应(填“吸热”或“放热”),判断的理由是降低温度平衡向放热反应方向移动,降低温度c(N2O4)浓度增大,平衡逆向移动.
(4)该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:BC
A.充入一定量的NO2
B.增大容器的容积
C.分离出一定量的NO2
D.充入一定量的N2
(5)100℃时,若将9.2gNO2和N2O4气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)<v逆(N2O4).(填“>”、“=”或“<”)
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
此温度下的化学平衡常数K为0.36.
(2)下列能说明该反应达到平衡状态的是BD
A.2v(N2O4)=v(NO2)
B.体系的颜色不再改变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热反应(填“吸热”或“放热”),判断的理由是降低温度平衡向放热反应方向移动,降低温度c(N2O4)浓度增大,平衡逆向移动.
(4)该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:BC
A.充入一定量的NO2
B.增大容器的容积
C.分离出一定量的NO2
D.充入一定量的N2
(5)100℃时,若将9.2gNO2和N2O4气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)<v逆(N2O4).(填“>”、“=”或“<”)
4.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| C. | Fe2(SO4)3溶液和Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
1.下列说法中错误的是( )
| A. | 在元素周期表金属与非金属分界线附近能找到制半导体材料的元素 | |
| B. | 离子键、共价键、氢键都是化学键 | |
| C. | 元素周期律是元素原子核外电子排布周期性变化的必然结果 | |
| D. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑 |
8.某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是试管.
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性.
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片、KSCN溶液.
实验记录(划斜线部分不必填写):
实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性.
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:AEF.(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化在亚铁盐溶液中加入少量铁单质,并简述Fe2+的检验的方法取少量亚铁盐溶液加入几滴KSCN溶液无明显现象,通入氯水后溶液呈血红色.
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是试管.
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性.
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片、KSCN溶液.
实验记录(划斜线部分不必填写):
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | Zn+Fe2+=Zn2++Fe | ||
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe3+具有氧化性 |
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:AEF.(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化在亚铁盐溶液中加入少量铁单质,并简述Fe2+的检验的方法取少量亚铁盐溶液加入几滴KSCN溶液无明显现象,通入氯水后溶液呈血红色.
18. 将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )
将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )
 将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )
将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )| A. | 固体NaOH | B. | 浓H2SO4 | ||
| C. | Ba(OH)2•8H2O与NH4Cl糊状物 | D. | CaO固体 |
5.下列实验操作中,正确的是( )
| A. | 稀释浓硫酸先在量筒中加一定体积水,再在不断搅拌下沿量筒壁慢慢加入浓硫酸 | |
| B. | 过滤时,漏斗里的滤液应低于滤纸的边缘 | |
| C. | 燃着的钠应立即用水灭火 | |
| D. | 测定溶液的pH值时,应用湿润玻棒蘸取待测液,直接滴在干燥的pH试纸上 |
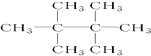 .
.