题目内容
17.下列说法正确的是( )| A. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| C. | 已知pOH=-lg[c(OH-)],又知体温下正常人的血液pH=7.35,则血液的pOH为6.65 | |
| D. | KCN溶液中有剧毒HCN挥发出来,为了减少HCN的生成,最佳方法是加入KOH |
分析 A.加水稀释,促进醋酸电离,但醋酸溶液中c(H+)降低,温度不变,离子积常数不变,据此判断溶液中c(OH-)变化;
B.醋酸是弱电解质部分电离,氯化氢是强电解质,完全电离,所以pH相同的醋酸和盐酸,醋酸浓度大于盐酸,pH、体积相等的醋酸和盐酸,n(CH3COOH)>n(HCl),中和酸需要的碱与酸的物质的量成正比;
C.体温下正常人的血液pH=7.35,则溶液中c(H+)=10-7.35mol/L,升高温度,促进水电离,则水的离子积常数大于10-14,则溶液中c(OH-)>$\frac{1{0}^{-14}}{1{0}^{-7.35}}$mol/L=10-6.65mol/L,根据pOH=-lg[c(OH-)]计算溶液的pOH;
D.HCN属于酸,酸能和碱反应生成盐而降低溶液毒性.
解答 解:A.加水稀释,促进醋酸电离,但醋酸溶液中c(H+)降低,温度不变,离子积常数不变,所以溶液中c(OH-)增大,故A错误;
B.醋酸是弱电解质部分电离,氯化氢是强电解质,完全电离,所以pH相同的醋酸和盐酸,醋酸浓度大于盐酸,pH、体积相等的醋酸和盐酸,n(CH3COOH)>n(HCl),中和酸需要的碱与酸的物质的量成正比,则醋酸消耗的NaOH物质的量大,故B错误;
C.体温下正常人的血液pH=7.35,则溶液中c(H+)=10-7.35mol/L,升高温度,促进水电离,则水的离子积常数大于10-14,则溶液中c(OH-)>$\frac{1{0}^{-14}}{1{0}^{-7.35}}$mol/L=10-6.65mol/L,所以血液中pOH小于6.65,故C错误;
D.KCN溶液中有剧毒HCN挥发出来,HCN属于酸,酸能和碱反应生成盐而降低溶液毒性,为了减少HCN的生成,最佳方法是加入KOH,故D正确;
故选D.
点评 本题考查较综合,涉及pH计算、弱电解质的电离、酸碱中和等知识点,为高频考点,易错选项是A,注意A选项中除了氢氧根离子外其它离子浓度都减小,题目难度不大.

| A. | 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | Fe2++Br2═Fe3++Br- |
| A. | 等于10mL | B. | 小于10mL | C. | 大于10mL | D. | 等于5mL |
| A. | 降低温度,溶液中c(NH4+)增大 | |
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 | |
| C. | 加入水时,溶液中c(OH-)/c(NH3•H2O) 增大 | |
| D. | 加入少量0.1 mol•L-1 HCl溶液,溶液中c(OH-)增大 |
| A. | 0.01mol•L-1HA的溶液中c(H+)=1×10-4 mol•L-1 | |
| B. | PH=3的HA溶液与PH=11的NaOH溶液等体积混合后所得溶液中c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)<c(HA)-c(A-) | |
| D. | PH=3的HA溶液与PH=11的NaOH溶液按体积比1:10混合后所得溶液中c(OH-)+c(A-)=c(H+)+c(Na+) |
| A. | 物质的量 | B. | 原子个数 | C. | 氢原子个数 | D. | 分子中的电子数 |

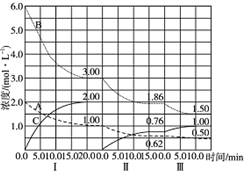 反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:
反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示: