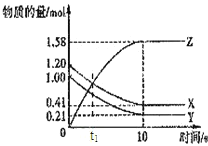
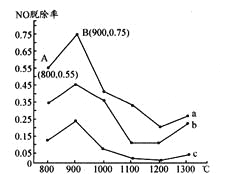
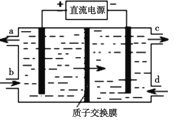
题目内容
【题目】为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验

下列叙述中不正确的是
A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1实验中反应速率为a>b,则一定可以说明Fe3+比Cu2+对H2O2分解催化效果好
C.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率
D.图2中关闭A处活塞,将针筒活塞向外拉,松开后针筒活塞复原说明装置气密性好
【答案】B
【解析】
据反应剧烈程度和反应现象的关系判断FeCl3与CuSO4对H2O2分解催化效果;据化学反应速率的概念分析反应的快慢;据气密性检查原理判断气密性的检查方法。
A、反应速率可以通过观察产生气泡的快慢来判断,故A正确;
B、若图甲所示实验中反应速率①>②,则能够说明FeCl3比CuSO4对H2O2分解催化效果好,但不一定是Fe3+和Cu2+,可能是硫酸根离子和氯离子,故B错误;
C、反应速率可以用单位时间内产生气体的快慢表示,故C正确;
D、关闭A处活塞,将注射器活塞拉出一定距离,若气密性不好,活塞不能回到原位,故D正确。
答案选B。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由_____。
(2)加入沸石的作用是_____。若加热后发现未加沸石,应采取的正确方法是______。
(3)上述装置图中,B仪器的名称是_____,D仪器的名称是_____。
(4)分液漏斗使用前必须进行的操作是_____(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在_____层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是_____。
(7)本实验中,正丁醛的产率为_____%。
【题目】在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始浓度和起始容积相同,一定条件下发生反应:![]() 。相关数据如表所示:下列说法正确的是( )
。相关数据如表所示:下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料n |
|
|
|
平衡时容器体积 |
|
|
|
反应的平衡常数K |
|
|
|
平衡时 |
|
|
|
平衡时 |
|
|
|
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()